O experimento “A serpente de faraó” é uma forma interessante de estudar a ocorrência de fenômenos químicos (reações químicas), isto é, a transformação de um ou mais materiais (reagentes) em outros (produtos). Uma reação química pode ser representada da seguinte forma:
A + B → C + D
Na equação acima, os reagentes são A e B, e os produtos são C e D. Essa equação evidencia que, em todo fenômeno químico, temos a transformação dos materiais contidos nos reagentes.
→ Os fatores que indicam a ocorrência de um fenômeno químico são:
-
Mudança de cor
-
Presença de fumaça
-
Produção de gás
-
Aquecimento espontâneo
-
Turvação (perde a transparência ou a limpidez)
-
Formação de um sólido
Veja agora o passo a passo para a realização do experimento “A serpente de faraó” e os fatores que comprovam a ocorrência de um fenômeno químico no experimento:
→ Materiais necessários para a realização do experimento
-
Açúcar comum (etanol)
-
Bicarbonato de sódio
-
Álcool comum
-
Êmbolo de seringa de 20 mL
-
1 garrafa PET de 250 mL
-
1 tesoura
-
Bacia grande com areia
-
1 palito de dente
-
Caixa de fósforos
-
1 cadinho ou cápsula de porcelana
-
1 pistilo
-
1 colher de chá
-
1 conta gotas
→ Procedimento
1o) Colocar no interior do cadinho uma colher de chá de bicarbonato de sódio e duas colheres de açúcar. Em seguida, misturar e macerar, utilizando o pistilo, até que a mistura torne-se o mais fina e homogênea possível;
2o) Cortar a garrafa PET, com o auxílio da tesoura, cerca de dois dedos abaixo da tampa;
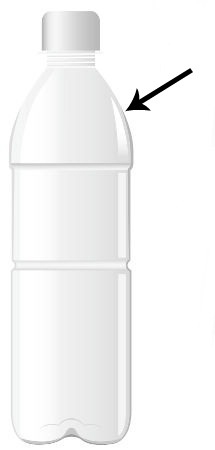
A seta indica o local em que devemos cortar a garrafa PET
3o) Adicionar, com o auxílio da colher de chá, a mistura do cadinho (1o procedimento) no interior da parte recortada da garrafa até a altura da tampa;
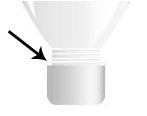
A seta indica até que ponto devemos adicionar a mistura contida no cadinho
4o) Adicionar de 10 a 15 gotas de álcool à mistura presente na tampa da garrafa pet. Logo após, misturar bem utilizando o palito de dente;
5o) Pressionar, utilizando o embolo da seringa, a mistura presente na tampa da garrafa para que ela fique bem compactada. O objetivo é formar uma pastilha com a mistura;
6o) Retirar a tampa da garrafa. Nela estará a mistura compactada;
7o) Retirar a pastilha da tampa com muito cuidado sobre a areia na bacia. O ideal é que ela seja retirada inteira.
8o) Adicionar álcool em volta e sobre a pastilha. Em seguida, riscar o fósforo.
9o) Observar os acontecimentos:
→ Precauções
-
Não deixar o frasco com álcool próximo ao experimento;
-
Não adicionar álcool diretamente na chama;
-
Não posicionar a pastilha próximo da borda da bacia.
→ Explicação do experimento
Quando colocamos fogo na pastilha, várias reações químicas diferentes ocorrem, formando assim uma massa preta cilíndrica que lembra uma serpente, que é constituída por substâncias oriundas da reação.
As reações químicas que ocorrem durante o experimento são:
-
Combustão do álcool comum (etanol):
C2H6O + 3 O2→ 2 CO2 + 3 H2O
Essa reação é importante porque é utilizada para a produção da chama, que, por sua vez, produzirá calor para a ocorrência das outras combustões e decomposições.
-
Combustão completa do açúcar
C12H22O11 + 12 O2→ 12 CO2 + 11 H2O
A combustão completa do açúcar produz gás carbônico e água.
-
Combustão incompleta do açúcar
C12H22O11 + O2→ 12 C + 11 H2O
A combustão incompleta do açúcar produz carvão (C) e água na forma de vapor. O carvão é um material sólido de coloração preta.
-
Decomposição do bicarbonato de sódio
NaHCO3 → Na2CO3 + CO2 + H2O
Nessa reação, o bicarbonato dá origem a três novos compostos: o carbonato de sódio, o gás carbônico e a água (na forma de vapor).
-
Decomposição do carbonato de sódio
Na2CO3 → Na2O + CO2
A decomposição térmica do carbonato de sódio (Na2CO3) produz óxido de sódio e gás carbônico.
Assim, analisando as equações, concluímos que os principais produtos formados durante as reações são carvão (C), óxido de sódio (Na2O) e gás carbônico (CO2).
O carvão forma com o óxido de sódio uma mistura (de cor negra) capaz de aprisionar o gás carbônico formado, em razão das forças intermoleculares entre o carvão e o óxido. Por conta disso, temos o aumento do tamanho da mistura negra cilíndrica (que lembra a serpente).
→ Por que podemos afirmar que ocorreu uma reação química?
As evidências da ocorrência de reação química são:
-
Coloração preta do material formado (indica mudança de cor, já que os reagentes utilizados não tinham essa coloração);
-
Crescimento desordenado do material formado;
-
Paredes cheias de aerações (indica a passagem de gás);
-
Presença de fumaça (indica a queima).
Por Me. Diogo Lopes Dias







