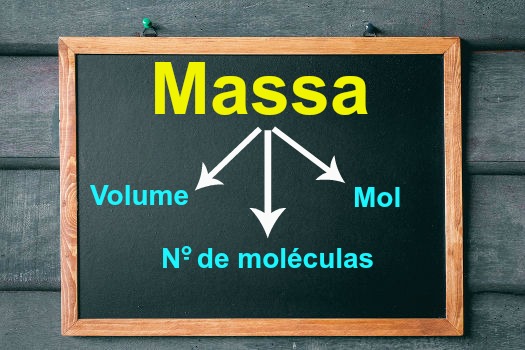
O principal objetivo do cálculo estequiométrico com massa é fornecer uma ideia sobre a massa de produto que será formada ou a massa de reagentes necessária para formar uma quantidade predeterminada de produtos. Esse cálculo também pode ser relacionado com as seguintes variáveis:
-
Quantidade de matéria (número de mol);
-
Quantidade de moléculas;
-
Volume.
Em todos os casos, é imprescindível que alguns padrões sejam sempre verificados, a saber:
-
Verificar se a equação química está balanceada; se não estiver, balancear;
-
Realizar os cálculos com regra de três simples;
-
A primeira linha da regra de três deve estar sempre relacionada com os coeficientes estequiométricos do balanceamento;
-
A segunda linha da regra de três deve estar relacionada com os dados do exercício.
Veja alguns exemplos:
a) Exemplo de cálculo estequiométrico com massa e mol
(PUC-RJ) A hidrazina, N2H4, e o peróxido de hidrogênio, H2O2, são utilizados como propelentes de foguetes. Eles reagem de acordo com a equação:
7H2O2 + N2H4 → 2HNO3 + 8H2O
Quando forem consumidos 3,5 moles de peróxido de hidrogênio, a massa, em gramas, de HNO3 formada será de:
a) 3,5
b) 6,3
c) 35,0
d) 63,0
e) 126,0
O enunciado trabalha com mol em relação ao H2O2 e pede a massa de HNO3. Para isso, devemos fazer o seguinte:
OBS.: Como a equação química apresenta os coeficientes 7, 2 e 8, ela está balanceada, ou seja, temos a relação 7 mol: 1 mol: 2 mol: 8 mol.
1º Passo: calcular a massa molar do HNO3. Para isso, devemos multiplicar a quantidade de cada átomo pela sua respectiva massa e, em seguida, somar os resultados:
HNO3 = 1.1 + 1.14 + 3.16
HNO3 = 1 + 14 + 48
HNO3 = 63 g/mol
2º Passo: montar a regra de três que relaciona massa e mol, como o enunciado pede. Nessa relação, vamos utilizar apenas as substâncias H2O2 e HNO3.
7H2O2 → 2HNO3
7 mol----------------2 mol
7 mol-------- 2. 63
3,5 mol-------- x g
7.x = 3,5.126
7x = 441
x = 441
7
x = 63 g
b) Exemplo de cálculo estequiométrico com massa e moléculas
(Unifor-CE) Para eliminar o dióxido de carbono, CO2, da atmosfera das naves espaciais, são utilizados recipientes com hidróxido de lítio, LiOH, adaptados à ventilação. A equação da reação entre essas substâncias está representada a seguir:
CO2(g) + 2LiOH(s) → Li2CO3(s) + H2O(l)
Considerando uma massa de LiOH de 100,0 g, o número de moléculas de CO2(g) que pode ser eliminado da atmosfera das naves é de, aproximadamente,
Dado: Constante de Avogadro = 6,0x1023 mol–1
a) 1,3x1024.
b) 6,2x1024.
c) 3,0x1023.
d) 1,5x1022.
e) 4,3x1021.
Solução: O enunciado trabalha com a massa do LiOH e pede o número de moléculas relacionado com essa massa. Para isso, devemos:
OBS.: Como a equação apresenta o coeficiente 2, ela está balanceada, ou seja, temos a relação 1 mol: 2 mol: 1 mol: 1 mol.
1º Passo: calcular a massa molar de LiOH. Para isso, devemos multiplicar a quantidade de cada átomo pela sua respectiva massa e, em seguida, somar os resultados:
LiOH = 1.7 + 1.16 + 1.1
LiOH = 7 + 16+ 1
LiOH = 24 g/mol
2º Passo: Montar a regra de três que relaciona massa e moléculas, como o enunciado pede. Nessa relação, vamos utilizar apenas as substâncias LiOH e CO2.
CO2(g) + 2LiOH(s)
1 mol----------------2mol
6.1023 moléculas-------- 2. 24
x moléculas-------- 100 g
48.x = 100.6.1023
48x = 600.1023
x = 600.1023
48
x = 12,5.1023
ou
x = 1,25.1024 moléculas
c) Exemplo de cálculo estequiométrico apenas com massa
(Unimep-SP) O cromo é obtido por aluminotermia, que usa o óxido de cromo-III (Cr2O3), proveniente do minério cromita (FeO. Cr2O3):
Cr2O3 + 2Al → 2Cr + Al2O3.
A massa de cromo obtida a partir de uma tonelada de óxido de cromo-III é aproximadamente igual a: Dados: M.A. de Cr = 52; M.A. de O = 16; M.A. de Al= 27)
a) 684,21 kg;
b) 177,63 kg;
c) 485,34 kg;
d) 275,76 kg;
e) 127,87 kg.
Solução: O enunciado trabalha com a massa do óxido de cromo III e pede a massa de cromo. Para isso, devemos:
OBS.: Como a equação apresenta o coeficiente 2, ela está balanceada, ou seja, temos a relação 1 mol: 2 mol: 2 mol: 1 mol.
1º Passo: calcular a massa molar do Cr2O3 (óxido de cromo III). Para isso, devemos multiplicar a quantidade de cada átomo pela sua respectiva massa e, em seguida, somar os resultados:
Cr2O3 = 2.52 + 3.16
Cr2O3 = 104 + 48
Cr2O3 = 152 g/mol
2º Passo: calcular a massa molar do Cr (cromo). Para isso, devemos multiplicar a quantidade de cada átomo pela sua respectiva massa e, em seguida, somar os resultados:
Cr = 1.52
Cr = 52 g/mol
3º Passo: transformar a massa do Cr2O3 fornecida pelo enunciado em Kg, já que a resposta deve ser em Kg. Para isso, basta multiplicar por 1000.
Massa do Cr2O3 = 1. 1000
Massa do Cr2O3 = 1000Kg
4º Passo: montar a regra de três que relaciona massa e moléculas, como o enunciado pede. Nessa relação, vamos utilizar apenas as substâncias Cr2O3 e Cr;
OBS.: As massas da 1ª linha podem permanecer em gramas porque se trata de uma regra de três. Assim, ao multiplicarmos cruzado, essas unidades anulam-se, sobrando o Kg da 2ª linha.
Cr2O3 → 2Cr
1 mol----------------2mol
152g -------- 2. 52g
1000Kg-------- x g
152.x = 1000.104
152x = 104000
x = 104000
152
x = 684,21Kg
d) Exemplo de cálculo estequiométrico com massa e volume
(Unirio-RJ) Jaques A. A. Charles, químico famoso por seus experimentos com balões, foi o responsável pelo segundo voo tripulado. Para gerar o gás hidrogênio, com o qual o balão foi cheio, ele utilizou ferro metálico e ácido, conforme a seguinte reação: Dados: H = 1; Fe = 56.
Fe(s) + H2SO4(aq) → FeSO4(aq) + H2(g)
Supondo-se que tenham sido utilizados 448 kg de ferro metálico; o volume, em litros, de gás hidrogênio obtido nas CNTP foi de:
a) 89,6
b) 179,2
c) 268,8
d) 89.600
e) 179.200
Solução: O enunciado trabalha com a massa do ferro metálico e pede o volume de gás hidrogênio. Para isso, devemos:
1º Passo: verificar o balanceamento da equação. Como ela está balanceada, temos a relação 1 mol: 2 mol: 1 mol: 1 mol.
2º Passo: calcular a massa molar do ferro metálico. Para isso, devemos multiplicar a quantidade de cada átomo pela sua respectiva massa e, em seguida, somar os resultados:
Fe = 1.56
Fe = 56 g/mol
3º Passo: passar a massa do ferro fornecida pelo enunciado para gramas, já que a massa molar foi calculada no 2º passo em gramas. Para isso, basta multiplicar por 1000.
Massa do Fe = 448. 1000
Massa do Fe = 448000 g
4º Passo: montar a regra de três que relaciona massa e moléculas, como o enunciado pede. Nessa relação, vamos utilizar apenas as substâncias Fe e H2.
OBS.: O volume molar utilizado na CNTP, como pede o enunciado, é de 22,4 L.
Fe(s) → H2(g)
1 mol----------------1mol
56g -------- 1. 22,4L
448000 g-------- x L
56.x = 448000.22,4
56x = 10035200
x = 10035200
56
x = 179200 L
Videoaulas relacionadas: