No ano de 1806, o químico e farmacêutico Joseph Louis Proust (1754-1826) enunciou a lei das proporções constantes, também conhecida como lei das proporções definidas ou, ainda, Lei de Proust. Essa lei é muito importante porque forneceu as bases para o atomismo e também é usada para a obtenção de outras fórmulas químicas importantes, tais como a fórmula molecular, a fórmula percentual ou centesimal e a fórmula mínima ou empírica.
A lei das proporções constantes de Proust pode ser enunciada da seguinte forma:

Enunciado da Lei de Proust
Para entender o que diz essa lei, considere um exemplo: Ao realizar experimentos, observamos que 10,0 g de cobre metálico reagem com 5,06 g de enxofre, formando como produto 15,06 g de sulfeto cúprico.
Cu(s) + S(s) → CuS(s)
↓ ↓ ↓
10,0 g 5,06 g 15,06 g
Segundo a lei de Proust, essa reação sempre ocorrerá nessa mesma proporção de massas. Por exemplo, se dobrarmos o valor do cobre metálico usado, veja o que acontecerá:
Cu(s) + S(s) → CuS(s) + Cu(s)
↓ ↓ ↓ ↓
20,0 g 5,06 g 15,06 g 10,0 g
parte em excesso parte que não reagiu
Veja que os 10 gramas de cobre sobraram como excesso e só reagiu a massa que a proporção definiu.
O mesmo ocorre se dobrarmos a quantidade de enxofre:
Cu(s) + S(s) → CuS(s) + S(s)
↓ ↓ ↓ ↓
10,0 g 10,12 g 15,06 g 5,06 g
parte em excesso parte que não reagiu
Viu, só?! Isso ocorre com qualquer quantidade a mais que acrescentarmos. Por exemplo, se usarmos 10 g de cobre e 8 g de enxofre, sobrarão 2,94 g de enxofre.
Mas se seguirmos a proporção e aumentarmos ou diminuirmos igualmente todas as massas, a reação ocorrerá de forma completa, sendo consumidos todos os reagentes, e a massa do produto também seguirá sempre as mesmas proporções:
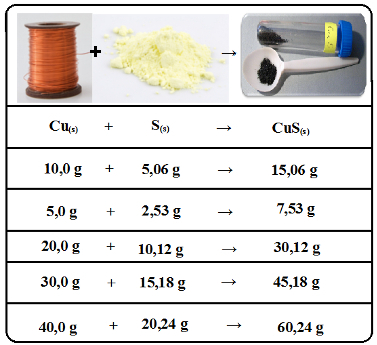
Dados experimentais em reação entre cobre e enxofre com formação de sulfeto cúprico confirmam a lei das proporções constantes
Essa é uma lei porque se aplica a todas as reações que envolvem substâncias puras. Mas observe que isso ocorre somente com substâncias puras (simples ou compostas), e não com misturas.
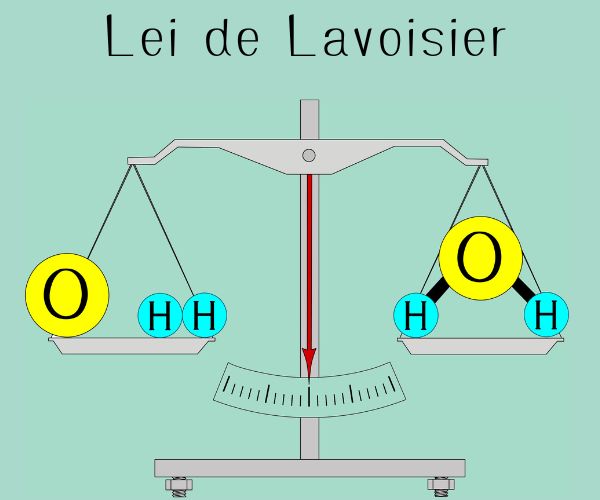
Outro ponto que podemos perceber nos dados mostrados na tabela acima é que essas reações também seguem a Lei de Lavoisier (Lei da conservação da massa), que diz que a massa do produto é igual à soma das massas dos reagentes.
Tanto a Lei de Lavoisier quanto a Lei de Proust são exemplos de Leis Ponderais, ou seja, são leis que relacionam as massas dos participantes de uma reação química.
Por Jennifer Fogaça
Graduada em Química