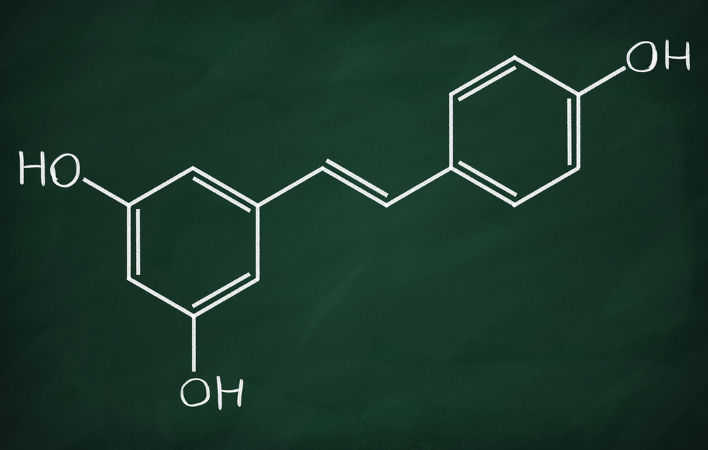
A isomeria geométrica, ou isomeria cis-trans, ocorre em moléculas que possuem a mesma fórmula molecular, inclusive com a mesma sequência de átomos ligados, mas que se diferem entre si pela posição que tais átomos ocupam no espaço. A condição para que a isomeria geométrica aconteça é a existência de duplas ligações entre carbonos ou de cadeias carbônicas fechadas (cíclicas).
Quando os carbonos da insaturação ou do ciclo possuem dois ligantes ou substituintes diferentes, os isômeros são classificados como cis ou trans, a depender se os ligantes estão no mesmo lado ou em lados opostos da dupla ligação, respectivamente.
No caso de os carbonos serem tri ou tetrassubstituídos, isto é, possuírem mais de dois ligantes diferentes, os isômeros são classificados pelas letras E ou Z, indicando a posição dos grupos de maior prioridade em relação à dupla ligação.
Leia também: Isomeria — o que é e os tipos possíveis desse fenômeno químico
Resumo sobre isomeria geométrica
-
A isomeria geométrica acontece quando moléculas de mesma estrutura química se diferenciam em razão da disposição espacial dos ligantes.
-
A isomeria geométrica é conhecida como isomeria cis-trans.
-
A condição para a isomeria geométrica é a existência de ligações duplas ou cadeias carbônicas fechadas.
-
Quando os carbonos envolvidos são dissubstituídos, utiliza-se o sistema cis-trans.
-
Isômeros cis mantêm os ligantes iguais no mesmo lado da ligação dupla ou do ciclo.
-
Isômeros trans mantêm os ligantes iguais em lados opostos da ligação dupla ou do ciclo.
-
Quando os carbonos envolvidos são tri ou tetrassubstituídos, é empregado o sistema E-Z.
-
No sistema E-Z, analisa-se a posição dos grupos de maior prioridade.
-
Átomos de maior número atômico possuem maior prioridade.
Videoaula sobre isomeria geométrica
O que é isomeria geométrica?
Isomeria geométrica, ou isomeria cis-trans, é uma forma da isomeria espacial em que os isômeros são formados pelos mesmos átomos — mantendo igual fórmula estrutural — e estão conectados em idêntica sequência, se diferindo apenas na orientação desses átomos no espaço.
Assim como os demais isômeros, os isômeros geométricos apresentam propriedades físico-químicas diferentes.
A International Union of Pure and Applied Chemistry (Iupac) incentiva o uso do termo “isomeria cis-trans” em vez de isomeria geométrica.
Quando ocorre a isomeria geométrica?
A isomeria geométrica acontece em moléculas que possuam algum ponto de rotação restrita dos átomos, como a existência de duplas ligações em alcenos ou estrutura em anel nos cicloalcanos. Nesses casos, os ligantes ou substituintes ocupam orientações espaciais fixas uns em relação aos outros.
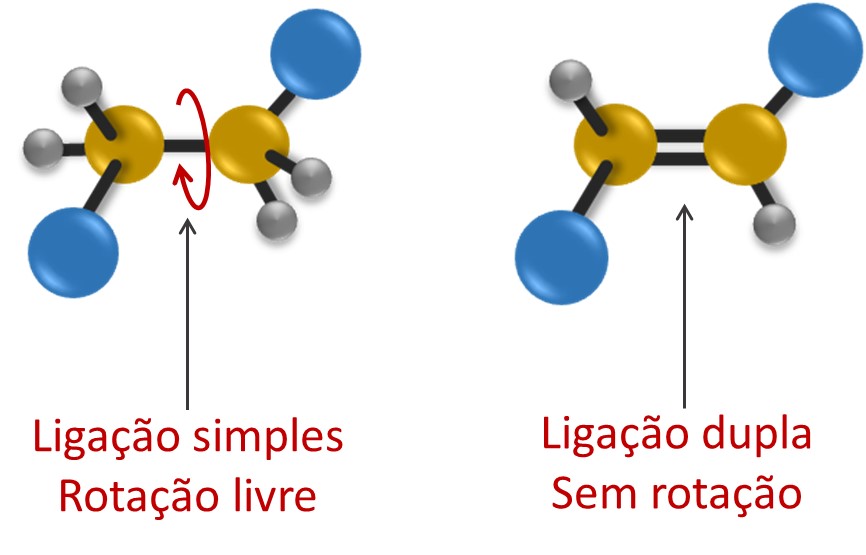
Quais são os tipos de isomeria geométrica?
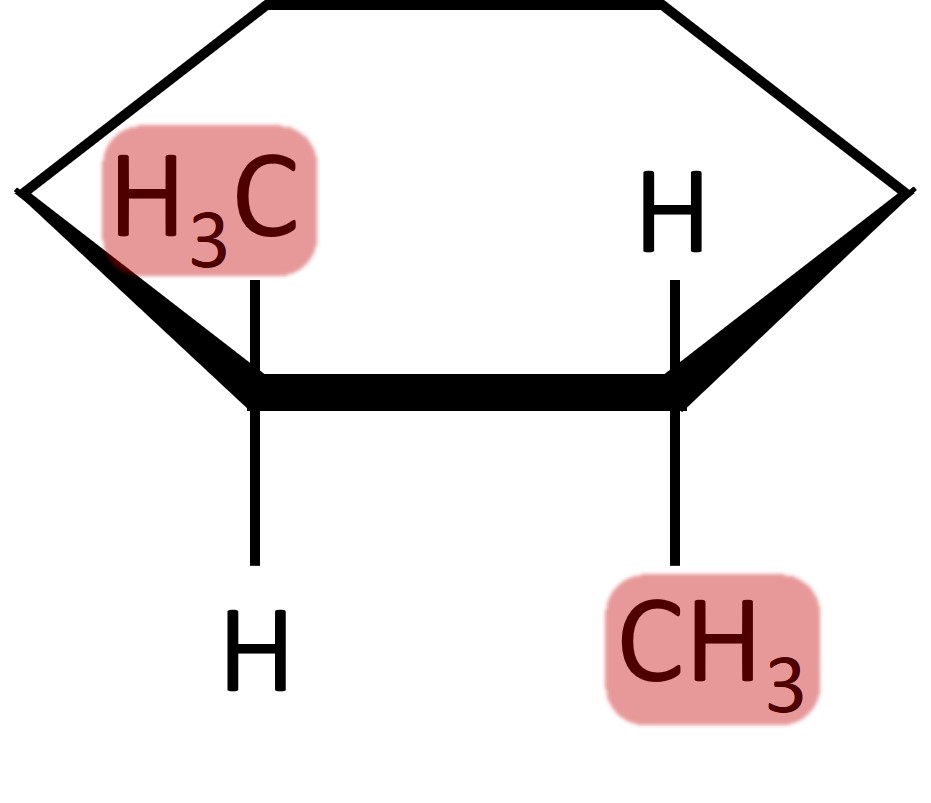
A isomeria geométrica é classificada em dois sistemas diferentes, dependendo do número de substituintes dos carbonos da insaturação ou da estrutura fechada.
A imagem abaixo indica o grau de substituição dos carbonos.
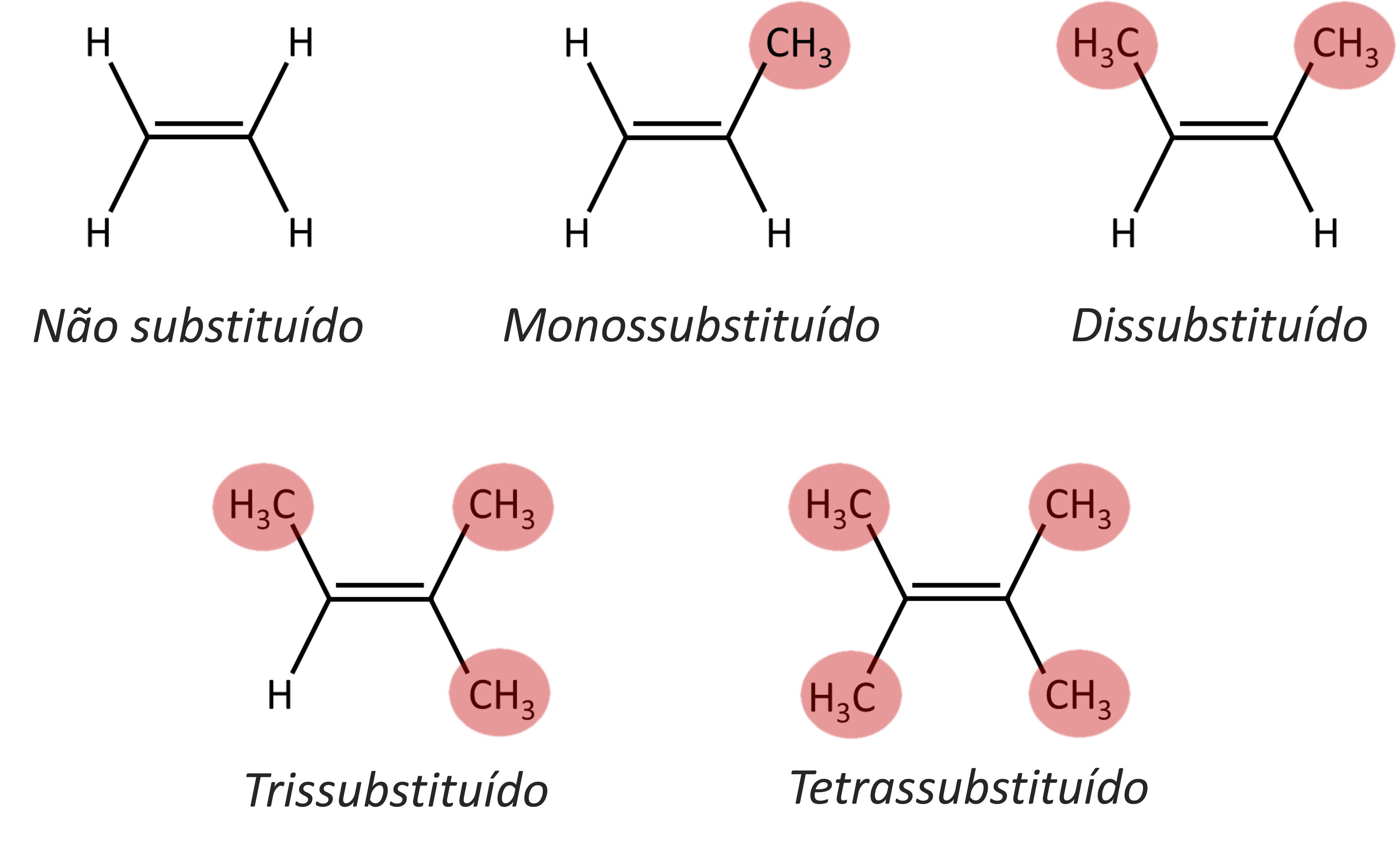
Em moléculas que possuem carbonos dissubstituídos, aplica-se a isomeria do tipo cis-trans.
Quando se tratar de moléculas formadas por carbonos com mais de dois substituintes, a nomenclatura cis-trans se torna ambígua, e, por isso, utiliza-se o sistema E-Z.
Leia também: Propriedades dos compostos orgânicos
Isomeria geométrica cis-trans
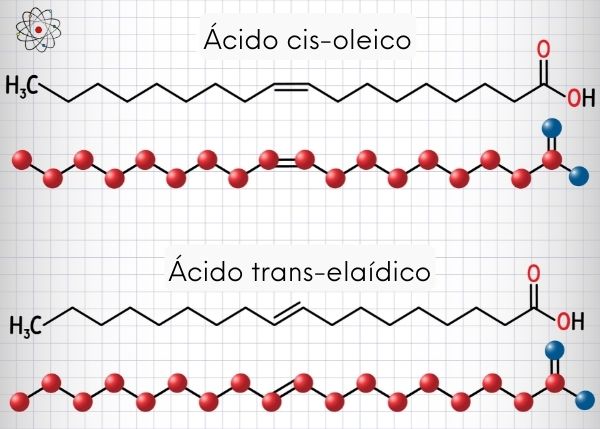
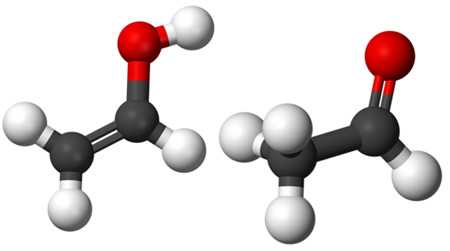
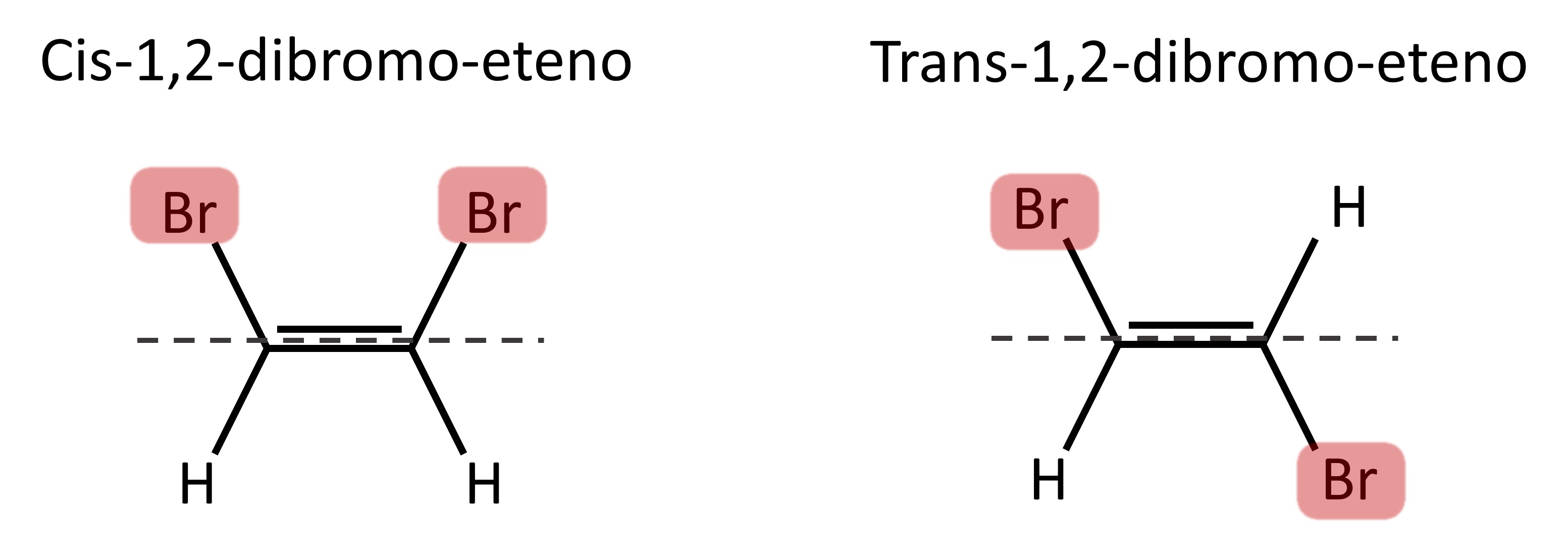
A isomeria cis-trans é uma forma de ocorrência da isomeria geométrica aplicada a moléculas com carbonos dissubstituídos.
-
Isômero cis
Nos isômeros cis, os substituintes estão localizados em um mesmo lado da ligação dupla ou do mesmo lado da estrutura em anel. Esse termo vem do vocabulário em latim, em que cis tem sentido de “próximo a”.
|
|
|
-
Isômero trans
Nos isômeros trans, os grupos substituintes ocupam posições opostas da dupla ligação ou estão em lados diferentes de um cicloalcano. A palavra trans deriva do latim e significa “através de”.
|
|
|
A nomenclatura dos isômeros geométricos é simples, bastando indicar o termo cis ou trans antes de escrever o nome do composto, de acordo com as orientações de nomenclatura da Iupac.
Isomeria geométrica E-Z
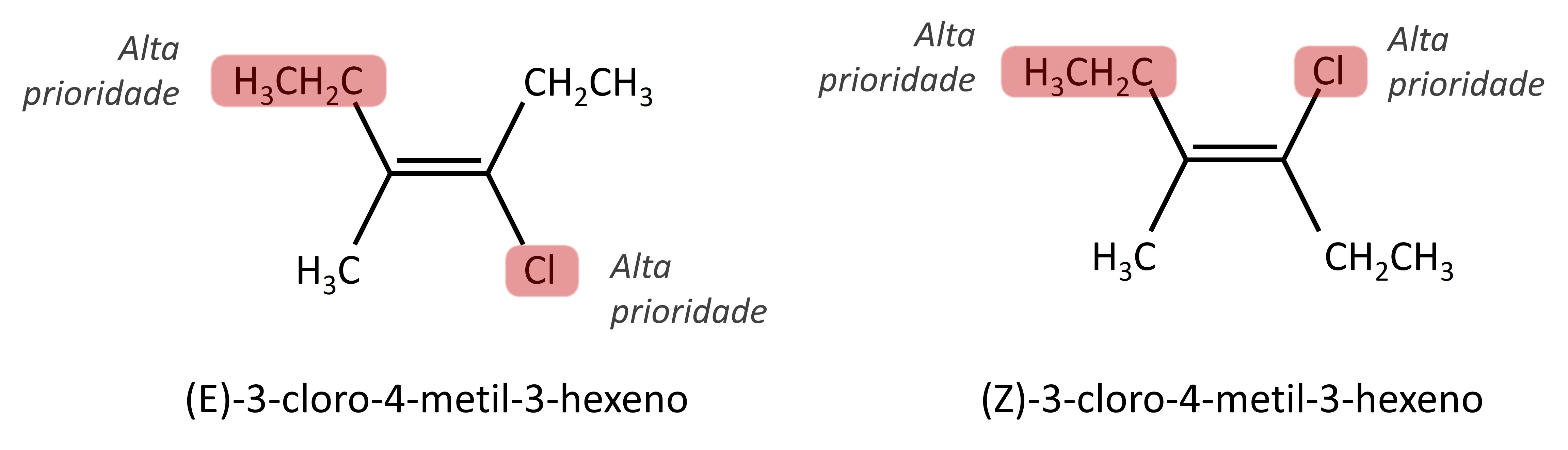
A isomeria E-Z é uma forma de ocorrência da isomeria geométrica aplicada em moléculas com carbonos trissubstituídos e tetrassubstituídos, ou seja, que possuem três ou quatro ligantes diferentes.
Nesse sistema são analisados os grupos substituintes ligados a cada átomo de carbono da insaturação, e a cada um deles é atribuído uma ordem de prioridade. A denominação E ou Z é definida de acordo com a orientação espacial dos dois grupos de maior prioridade. Átomos de maior número atômico têm maior prioridade:

Se houver empate entre os grupos substituintes na primeira ligação, aplicam-se os mesmos critérios de prioridade à ligação seguinte.
-
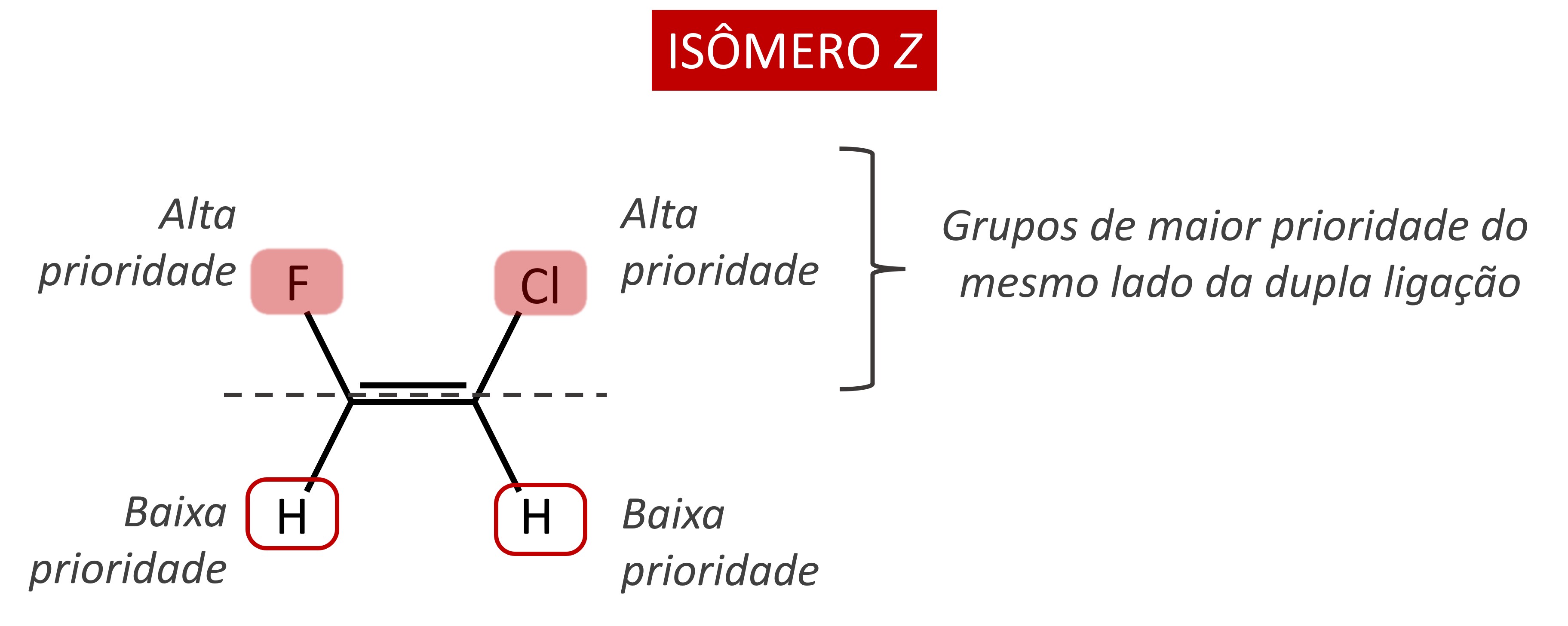
Isômero Z
Se os grupos de maior prioridade estiverem no mesmo lado do plano imaginário que passa pelos carbonos da dupla ligação, os isômeros são denominados Z. Essa letra faz referência ao termo alemão Zusammen, que possui sentido de “juntos”.
-
Isômero E
Quando os grupos de maior prioridade se apresentam em lados opostos da ligação dupla, a isomeria da molécula é definida como E. Essa letra faz referência ao termo alemão Entgegen, que possui sentido de “opostos”.
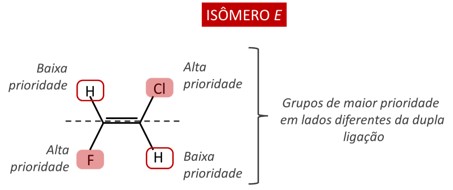
O sistema E-Z também se aplica a moléculas com dois ligantes. A notação cis-trans é, ainda, a mais usual para carbonos dissubstituídos, mas é importante reconhecer que o sistema de ordem de prioridade também é aplicável a esses casos.
A identificação de isômeros Z ou E é feita na escrita dos nomes das moléculas apenas pela indicação do tipo de isomeria (E ou Z) na frente do nome oficial, cuja construção segue as normas da Iupac.
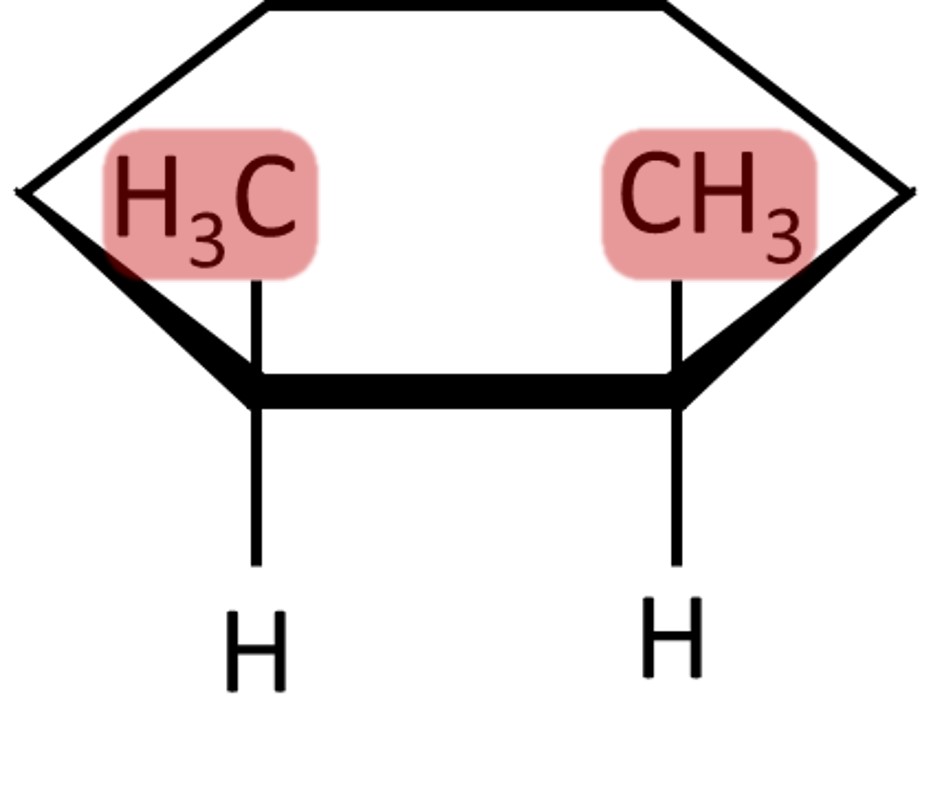
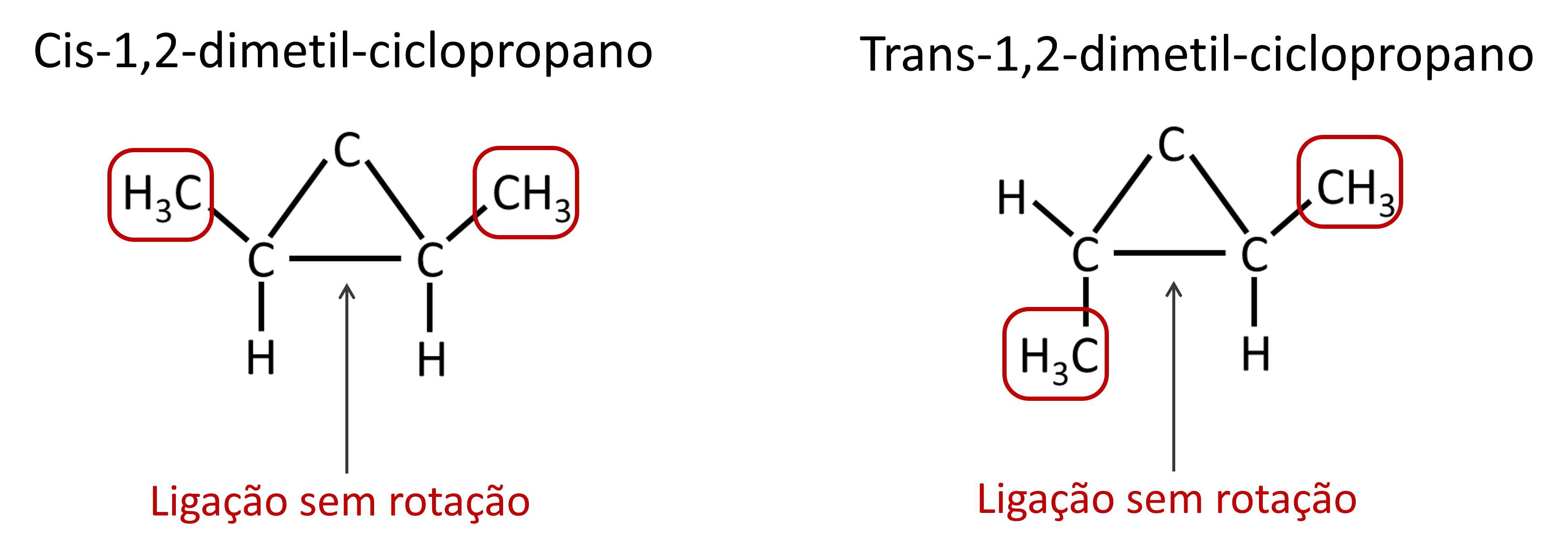
Isomeria geométrica em compostos cíclicos
Em cadeias fechadas, em razão da própria existência do anel, há impedimento da rotação livre em torno de ligações carbono-carbono. Dessa forma, quando houver dois ligantes ou substituintes diferentes em dois carbonos vizinhos no ciclo, ocorre a isomeria geométrica ou cis-trans.
Exercícios resolvidos sobre isomeria geométrica
Questão 1
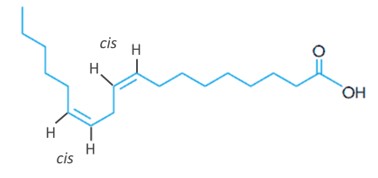
(Uerj) O ácido linoleico, essencial à dieta humana, apresenta a seguinte fórmula estrutural espacial:
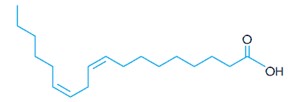
Como é possível observar, as ligações duplas presentes nos átomos de carbono 9 e 12 afetam o formato espacial da molécula. As conformações espaciais nessas ligações duplas são denominadas, respectivamente:
a) cis e cis
b) cis e trans
c) trans e cis
d) trans e trans
Resolução:
Letra A
Analisando as duas insaturações das moléculas, observa-se que os ligantes não mostrados são átomos de hidrogênio. Em ambas as insaturações, os átomos de hidrogênio estão do mesmo lado da ligação dupla, logo estão em posição cis.
Questão 2
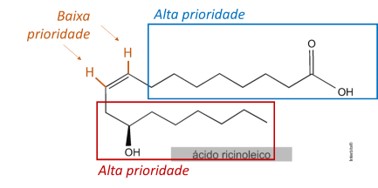
(UFSM — adaptada) A mamoneira é uma planta oleaginosa que produz o óleo de mamona, uma fonte renovável de biomateriais de grande valor econômico. Dela é extraído o ácido ricinoleico, um ácido graxo ômega 9. Esse ácido é conhecido desde a Antiguidade pelos efeitos analgésico, anti-inflamatório e bactericida. Além disso, em nosso tempo, tornou-se um insumo industrial utilizado para produção de poliuretanos usados em preenchimentos ósseos e de polímeros tipo epóxi empregados como tintas e adesivos impermeabilizantes.
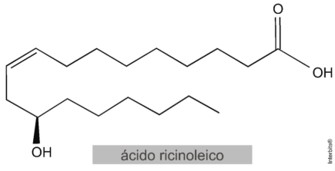
Sobre características desse ácido, afirma-se:
I. Possui configuração geométrica E.
II. Não apresenta isomeria espacial.
III. O seu enantiômero possui configuração geométrica Z.
Está(ão) correta(s)
a) apenas I.
b) apenas III.
c) apenas I e III.
d) apenas II e III.
e) I, II e III.
Resolução:
Letra B
A molécula demonstrada apresenta uma insaturação com ligantes diferentes, por isso apresenta isomeria espacial (afirmativa II incorreta). Como os carbonos da insaturação são trissubstituídos, aplica-se o sistema de isomeria E-Z.
Isômeros E possuem os grupos de alta prioridade em lados opostos da ligação dupla. Isômeros Z possuem os grupos de alta prioridade do mesmo lado da ligação dupla.
Na ilustração abaixo, estão destacados os grupos de alta e baixa prioridade. Note que os grupos de alta prioridade estão do mesmo lado da insaturação, logo trata-se de um isômero Z (afirmativa I incorreta e III correta).