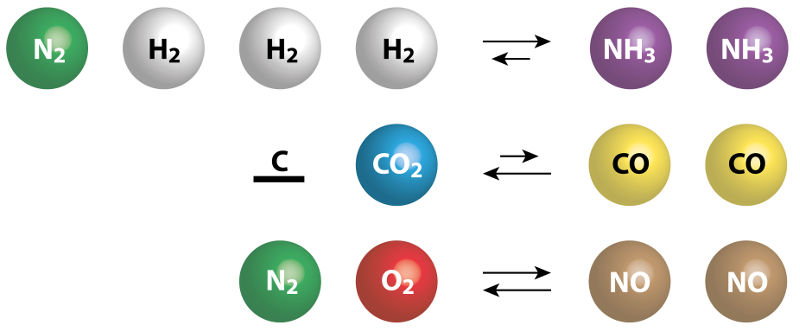
O equilíbrio químico é um fenômeno que ocorre em reações reversíveis e é caracterizado por velocidades iguais das reações direta e inversa, implicando iguais taxas de formação e de consumo das espécies envolvidas na reação química. O equilíbrio químico pode ser afetado por alterações de concentração das espécies, temperatura e pressão.
As expressões para a constante de equilíbrio expressam a proporção entre produtos e reagentes na condição de equilíbrio químico, permitindo identificar se a reação favorece a formação de produtos ou reagentes.
Leia também: Físico-química — área que estuda os fenômenos observados nas reações
Resumo sobre equilíbrio químico
-
Equilíbrio químico é um fenômeno que ocorre em reações reversíveis.
-
O equilíbrio químico é caracterizado por velocidades iguais das reações direta e inversa.
-
No equilíbrio químico, as concentrações de reagentes e produtos são constantes.
-
Para o equilíbrio químico se estabelecer, o sistema deve ser fechado e a temperatura, constante.
-
A constante de equilíbrio demonstra a proporção entre produtos e reagentes no equilíbrio químico.
-
O equilíbrio químico pode ser deslocado por alterações de temperatura, pressão e concentração de reagentes e produtos, de acordo com o princípio de Le Chatelier.
Videoaula sobre equilíbrio químico
O que é equilíbrio químico?
O equilíbrio químico é um fenômeno que ocorre em reações químicas reversíveis e que se estabelece quando a velocidade formação dos produtos é igual à velocidade de regeneração dos reagentes.
Em reações reversíveis, sob determinadas condições, os reagentes se transformam em produtos (reação direta) e, ao mesmo tempo, os produtos também são convertidos em reagentes (reação inversa). Reações químicas reversíveis são representadas por uma dupla seta, exatamente para indicar que a reação ocorre nos dois sentidos.

Esse equilíbrio se estabelece quando as velocidades das reações direta (\(v_{direta}\)) e inversa (\(v_{inversa}\)) são iguais:
\(v_{direta}=v_{inversa}\)
O equilíbrio químico é um processo dinâmico em que a reação ocorre nos dois sentidos e com a mesma velocidade. Por isso, após a condição de equilíbrio químico ser atingida, as concentrações dos reagentes e dos produtos são constantes.
Condições para ocorrer o equilíbrio químico
O equilíbrio químico apenas ocorre em reações reversíveis e somente é atingido quando:
-
a temperatura do sistema for mantida constante;
-
o sistema for fechado, isto é, não realizar trocas de matéria com o ambiente.
Para entender a importância de o sistema ser fechado, imagine uma reação em que gases são formados como produtos. Os gases se espalham rapidamente na atmosfera, não havendo como esses produtos gasosos serem transformados em reagentes.

Gráfico do equilíbrio químico
A ocorrência do equilíbrio químico pode ser verificada pela análise gráfica do sistema reacional, considerando a variação da concentração de reagentes e produtos ou a velocidade das reações direta e inversa em função do tempo.
-
Gráfico velocidade vs. tempo
De acordo com o gráfico de velocidade por tempo, a velocidade da reação direta é máxima no início da reação, pois as concentrações dos reagentes são altas. Conforme a reação acontece, a concentração dos reagentes diminui, em razão da conversão aos produtos, e a velocidade da reação direta vai diminuindo.
A velocidade da reação inversa é mínima no início, pois ainda não existem produtos. Conforme eles vão sendo formados durante a reação, a velocidade da reação inversa vai aumentando.
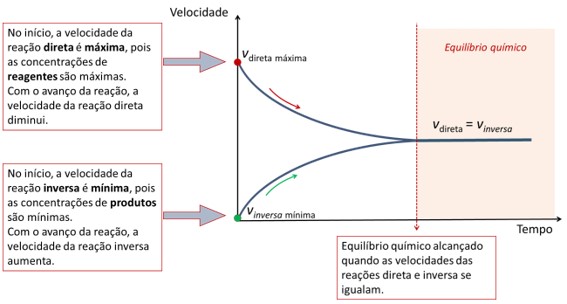
Em um determinado tempo de reação, as velocidades das reações direta e inversa se igualam e o equilíbrio químico é alcançado.
-
Gráfico concentração vs. tempo
As concentrações de reagentes e produtos se alteram com o tempo de ocorrência da reação. Inicialmente, a concentração de reagentes é máxima e vai diminuindo com o avanço da reação. Ao mesmo tempo, os produtos estão sendo formados e sua concentração aumenta. Em determinado tempo decorrido, as concentrações de reagentes e produtos se tornam constantes, indicando que a condição de equilíbrio químico foi atingida.
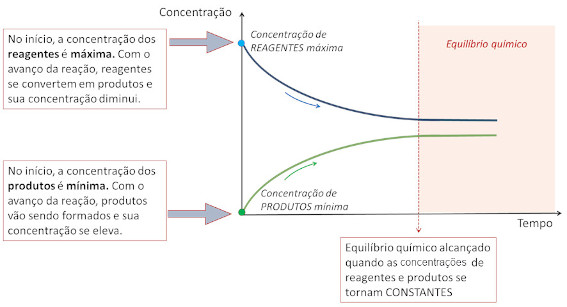
Constante de equilíbrio (K)
Ao alcançar o equilíbrio químico, as concentrações de reagentes e produtos se tornam constantes, no entanto dificilmente são iguais. No gráfico apresentado, por exemplo, a concentração dos reagentes é superior à concentração dos produtos no equilíbrio.
Para estimar quantitativamente as concentrações das substâncias envolvidas no equilíbrio químico, é definida uma constante de equilíbrio (K), calculada pela relação:
\(K=\frac{[produtos]}{[reagentes]}\)
O uso de colchetes ([ ]) na Química se refere à concentração molar da substâncias químicas.
A constante de equilíbrio depende apenas da temperatura e pode ser expressa em termos de concentração molar ou de pressão parcial, de acordo com o estado físico das substâncias envolvidas.
Observando os valores de K, é possível fazer previsões sobre a reação química:
-
Quando K for superior a 1 (K > 1), a reação é favorecida no sentido dos produtos.
-
Quando K for inferior a 1 (K < 1), a reação é favorecida no sentido dos reagentes.
-
Quando K é igual a 1 ou muito próximo (K ≈ 1), o equilíbrio possui concentrações muito próximas de reagentes e produtos.
-
Constante de equilíbrio em função da concentração (Kc)
Considere esta reação química genérica:
\(aA+bB \rightleftharpoons cC+dD\)
A expressão para a constante de equilíbrio em função da concentração será:
\(K_c=\frac{[C]^c [D]^d}{[A]^a[B]^b}\)
Os valores entre colchetes são as concentrações de cada espécie, e os termos minúsculos (a, b, c, d) são os coeficientes estequiométricos da reação.
|
EXEMPLO |
|
Reação: \(\mathbf{H_2\ (g)+ I_2 (g) \rightleftharpoons 2\ HI(g)}\) |
|
Expressão para Kc: |
|
\(\mathbf{K_c=\frac{[HI]^2}{[H_2] [I_2]}}\) |
|
Sabendo que as concentrações no equilíbrio são: \(\mathbf{[H_2 ]}\) = 0,2 mol/L \(\mathbf{[I_2 ]}\) = 0,4 mol/L \(\mathbf{[HI ]}\) = 1,2 mol/L É possível calcular o valor de KC para a reação. \(\mathbf{K_c=\frac{[1,2]^2}{[0,2] [0,4])}}\) \(\mathbf{K_c=18}\) |
Atenção deve ser dada a sistemas químicos que contenham espécies no estado sólido. A concentração de sólidos é considerada constante e já está incluída no próprio valor de KC, sendo desconsiderada na construção da expressão de KC. Veja:
\(2\ NaHCO_3 (\color{red}s) \rightleftharpoons Na_2\ CO_3\ (\color{red}s)+ CO_2\ (\color{red}g)+ H_2 O\ (\color{red}g)\)
\(K_c=[CO_2 ].[H_2 O] \)
-
Constante de equilíbrio em função das pressões parciais (KP)
Quando existem componentes gasosos no sistema químico em estudo, a expressão constante de equilíbrio pode ser expressa nos termos das pressões parciais (p) dos gases no equilíbrio:
\(K_P=\frac{(pC)^c (pD)^d}{(pA)^a(pB)^b }\)
|
EXEMPLO |
|
Reação: \(\mathbf{2\ CO\ (g)+ O_2\ (g) \rightleftharpoons 2\ CO_2\ (g)}\) |
|
Expressão para KP: |
|
\(\mathbf{K_P=\frac{(pCO_2)^2}{(pCO)^2 (pO_2)}}\) |
|
Sabendo que as concentrações no equilíbrio são: \(\mathbf{pCO}\) = 0,3 atm \(\mathbf{pO_2}\) = 0,75 atm \(\mathbf{pCO_2}\) = 2,1 atm É possível calcular o valor de KP para a reação. \(\mathbf{K_P=\frac{(2,1)^2}{(0,3)^2 (0,75)}}\) \(\mathbf{K_c=65,3}\) |
Apenas fazem parte da expressão de KP espécies que estejam no estado gasoso.
-
Qual a relação entre KC e KP?
As constantes de equilíbrio KP e KC são relacionadas por meio da fórmula matemática:
\(K_P= K_C\ (R\ T)^{Δn}\)
Sendo:
- R a constante dos gases, equivalente a 0,082 atm L mol-1 K-1, para dados de pressão expressos em atm;
- T a temperatura em Kelvin,
- Δn a variação entre os coeficientes das substâncias em estado gasoso.
Essa relação é derivada da equação de Clapeyron e é útil para a análise de equilíbrios químicos que envolvam espécies gasosas, líquidas e aquosas.
-
Constante do produto de solubilidade (KPS)
A constante do produto de solubilidade é empregada na ocorrência de equilíbrio químico entre um sal pouco solúvel e um solvente. Apesar da baixa solubilidade, uma pequena quantidade do sal sofre dissolução formando uma solução saturada em equilíbrio com o sólido, estabelecendo um equilíbrio de dissolução.
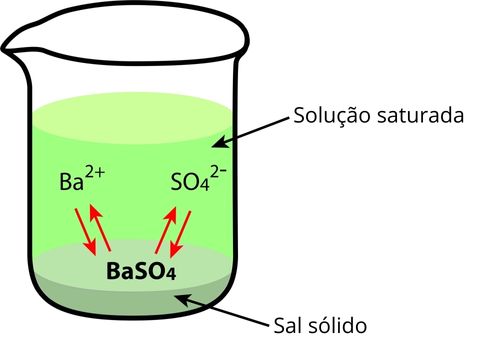
O sulfato de bário é um sal de baixa solubilidade em água, mas nesse meio estabelece o seguinte equilíbrio químico de dissolução:
\(BaSO_4\ (s) \rightleftharpoons Ba^{2+} (aq)+SO_4^{2-}\ (aq)\)
A construção da expressão de constante de equilíbrio segue o mesmo padrão já conhecido. Note que o BaSO4 é um sólido, logo não faz parte da expressão.
\(K_PS=[Ba^{2+} ][SO_4^{2-}]\)
Leia também: Estudo gráfico do coeficiente de solubilidade
Grau de equilíbrio
O grau de equilíbrio (α) fornece a quantidade percentual de matéria de uma substância que efetivamente reagiu em uma reação química. É dada pela relação:
\(α=\frac{números\ de\ mols\ que\ reagiram}{número\ de\ mols\ inicial}\ x\ 100%\)
Quanto maior o valor do grau de equilíbrio, maior a taxa de conversão de reagentes em produtos.
Tipos de equilíbrio químico
Os tipos de equilíbrio químico dependem da fase das substâncias envolvidas.
-
Equilíbrio químico homogêneo
Em sistemas homogêneos, todas as substâncias participantes da reação possuem o mesmo estado físico. Nessa situação, a concentração de todas as substâncias compõe o valor da constante de equilíbrio.
Na reação abaixo, reagentes e produtos estão na fase gasosa, e a concentração de todas as substâncias afeta a constante de equilíbrio.
\(H_2\ (g)+ I_2\ (g) \rightleftharpoons 2\ HI(g)\)
\(K_C=\frac{ [HI]^2}{[H_2 ][I_2 ]}\)
Sistemas gasosos e sistemas aquosos são classificados como equilíbrios químicos homogêneos.
-
Equilíbrio químico heterogêneo
Em sistemas heterogêneos, as substâncias envolvidas estão em estados físicos diferentes, sendo possível a identificação de fases diferentes.
A reação de decomposição térmica do carbonato de cálcio (CaCO3) é um exemplo de equilíbrio químico heterogêneo.
\(CaCO_3\ (s) \rightleftharpoons CaO\ (s)+CO_2\ (g)\)
A expressão da constante de equilíbrio para sistemas heterogêneos não considera a concentração de substâncias sólidas, pois se admite que elas são constantes (na realidade, se alteram muito pouco). Por isso, para a reação acima, a equação da constante de equilíbrio considera apenas a concentração da substância gasosa:
Leis do equilíbrio químico
-
Lei de ação das massas
A lei de ação das massas determina que a velocidade da reação é proporcional às concentrações molares (em mol L-1) dos reagentes, elevadas aos seus coeficientes estequiométricos.
Considerando novamente a equação química genérica \(\mathbf{A+B \rightleftharpoons C+D}\) para a reação direta, a velocidade é expressa pela relação:
\(v_{direta}= k_{direta}\ [A]^a [B]^b\)
E a velocidade da reação inversa é expressa de forma similar:
\(v_{inversa}= k_{inversa}\ [C]^c [D]^d\)
Como o equilíbrio químico é alcançado quando a \(v_{direta}= v_{inversa}\), a combinação matemática das duas relações acima dá origem à expressão da constante de equilíbrio químico (K).
\(K_c=\frac{[C]^c [D]^d}{[A]^a [B]^b}\)
A lei da ação das massas determina que a constante de equilíbrio químico considere as concentrações das espécies no equilíbrio. Dessa forma, não importa as quantidades iniciais de reagentes ou produtos, pois na condição de equilíbrio sempre haverá uma proporção fixa entre as concentrações das espécies envolvidas. Assim, o valor de K depende apenas da temperatura e da pressão (no caso de gases).
Essa lei foi entendida e enunciada pelos cientistas Cato Maximilian Guldberg e Peter Waage, em 1864.
-
Princípio de Le Chatelier
O princípio de Le Chatelier foi enunciado pelo químico Henry Louis Le Chatelier em 1884, durante seus estudos sobre sistemas químicos.
Em seus experimentos em laboratório, o pesquisador notou que sempre que algum tipo de alteração é induzida em um sistema que já tenha alcançado a condição de equilíbrio químico, o próprio sistema se ajusta a fim de minimizar ou anular tal alteração, encontrando uma nova condição de equilíbrio químico.
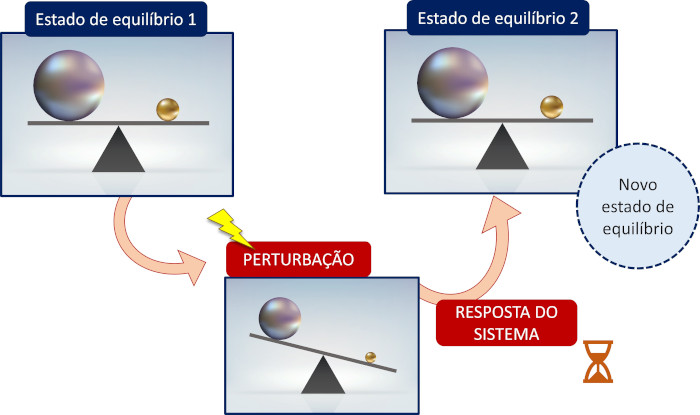
Esse processo de o sistema se autoajustar é conhecido como deslocamento do equilíbrio químico. Diversos tipos de perturbação são capazes de alterar a posição de um equilíbrio químico, tais como a variação de temperatura e pressão, a mudança da concentração de reagentes e produtos ou a composição do sistema.
Deslocamento do equilíbrio químico
O deslocamento do equilíbrio químico é um autoajuste de um sistema, que já estava em uma condição de equilíbrio químico, diante de algum tipo de perturbação externa, como enuncia o princípio de Le Chatelier, buscando uma nova condição de equilíbrio químico.
-
Efeito da concentração das espécies
Ao aumentar a concentração de uma espécie em um sistema em equilíbrio, a posição do equilíbrio químico será alterada (ou deslocada) a fim de consumir a espécie que está em excesso.
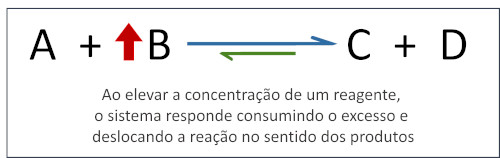
Quando alguma das espécies participantes tem sua concentração diminuída ou é removida do sistema, o equilíbrio é deslocado a fim de produzir mais dessa substância.
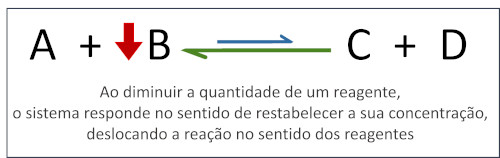
-
Efeito da temperatura
As reações químicas ocorrem por meio de absorção ou liberação de calor, sendo classificadas como reações exotérmicas e endotérmicas, respectivamente. Assim, a variação de temperatura interfere no deslocamento do equilíbrio químico.
Quando o sistema sofre um resfriamento por redução da temperatura, o equilíbrio químico é deslocado no sentido de formação de calor, ou seja, no sentido exotérmico da reação.
Adotando o mesmo raciocínio, quando o sistema é aquecido, naturalmente o equilíbrio químico é alterado para consumir o excesso de calor, deslocando a reação química no sentido endotérmico.
-
Efeito da pressão
As variações de pressão são relevantes em sistemas que contenham substâncias gasosas. A elevação da pressão total faz com que o equilíbrio químico seja deslocado para o sentido que contenha o menor volume, ou seja, a menor quantidade de gases.
A redução da pressão total de um sistema leva o equilíbrio químico a se deslocar no sentido de maior volume ocupado e maior quantidade de gases.
Leia também: Qual é a diferença entre processos endotérmicos e exotérmicos?
Casos particulares de equilíbrio químico
-
Equilíbrio iônico da água (KW)
A água sofre autoionização, estabelecendo um equilíbrio químico com seus íons, conhecido como equilíbrio iônico da água.
\(H_2 O\ (l) \rightleftharpoons H^+ \ (aq)+OH^- (aq)\)
A constante de equilíbrio para essa reação química é representada por KW e é expressa de forma similar ao que já vimos, desconsiderando a influência da água líquida, em razão de sua alta concentração.
\(K_w=[H^+ ] [OH^-]\)
O equilíbrio iônico da água ocorre em baixíssima extensão, significando que a menor parte das moléculas de água está dissociada em íons H+ e OH-. No entanto, a ocorrência desse fenômeno é muito importante, pois a presença de substâncias dissolvidas em água altera as quantidades de íons H+ e OH-. E, pela medida dessas concentrações, é possível classificar os sistemas químicos em ácidos, básicos e neutros, de acordo com a escala de pH.
-
Soluções-tampão
As soluções-tampão são soluções aquosas entre um ácido fraco ou base fraca com um sal. A mistura entre essas substâncias forma um sistema em que coexistem dois equilíbrios químicos.
A função da solução-tampão é manter o pH de um sistema praticamente constante, mesmo que sejam adicionadas determinadas quantidades de substâncias ácidas ou básicas fortes.
Como existem dois equilíbrios químicos agindo simultaneamente, as alterações de concentração que causam um deslocamento de equilíbrio em uma das reações são automaticamente compensadas pelo segundo equilíbrio. O resultado líquido disso é a manutenção dos valores de pH do meio.
Soluções-tampão estão presentes em nosso organismo, pois moléculas biológicas são altamente sensíveis às variações de pH. O sangue, por exemplo, é uma solução-tampão.
Outras fórmulas utilizadas no equilíbrio químico
As expressões mais importantes sobre equilíbrio químico são as fórmulas de KC e KP. No entanto, existem outros sistemas que possuem suas próprias relações matemáticas para representar o equilíbrio químico:
-
Constante de dissociação ácida (KA)
Os ácidos se dissociam em água, formando íons H+ e ânions:
\(HA\ (aq) \rightleftharpoons H^+ (aq)+ A^- \ (aq)\)
O equilíbrio de dissociação ácida é expresso pela relação de KA, que é a constante de dissociação ácida:
\(K_A=\frac{[H^+ ] [A^-]}{[HA]}\)
-
Constante de dissociação básica (KB)
As bases também se dissociam em água, liberando íons OH- e cátions:
\(BOH\ (aq) \rightleftharpoons B^+ (aq)+OH^-\ (aq)\)
O equilíbrio de dissociação básica é expresso pela relação de KB, que é a constante de dissociação básica:
\(K_B=\frac{[B^+ ] [OH^-]}{[BOH]}\)
Leia também: Reações reversíveis e equilíbrio químico
Exercícios resolvidos sobre equilíbrio químico
Questão 1
(Cesmac) O monóxido de nitrogênio (NO) é um dos subprodutos da queima de combustíveis fósseis. Quando liberado na atmosfera, pode reagir com a água presente nas nuvens produzindo o ácido nítrico e, consequentemente, chuva ácida. Na reação de síntese de NO descrita a seguir, suponha que o sistema esteja em equilíbrio e que as pressões dos gases sejam: PN2 = 0,1 atm, PO2 = 0,2 atm e PNO = 1,0 atm.
Qual é o valor da constante de equilíbrio (KP)?
\(N_2\ (g)+ O_2\ (g) \rightleftharpoons 2\ NO\ (g)\)
a) 1,3
b) 0,02
c) 20
d) 10
e) 50
Resolução:
Letra E
A expressão para a constante de equilíbrio é dada pela relação entre produtos/reagentes. Nesse caso, pede-se KP, que é a constante de equilíbrio em função das pressões parciais dos gases. Assim:
\(K_P=\frac{(pNO)^2}{(pN_2) (pO_2)}\)
Não esqueça de considerar os coeficientes estequiométricos da reação.
\(K_P=\frac{ (1,0\ atm)^2}{(0,1\ atm) (0,2\ atm)}\)
\(K_P=\frac{ (1,0\ atm)}{(0,02\ atm)}\)
\(K_P=50\)
As constantes de equilíbrio são adimensionais, ou seja, não possuem unidade.
Questão 2
(PUC-Minas) A síntese do amoníaco pelo processo de Haber-Bosch pode ser resumida na seguinte equação química:
\(N_2\ (g)+3 H_2\ (g) \rightleftharpoons 2 NH_3\ (g)\)
ΔH° = -92,6 KJ mol-1
Um aluno, analisando a equação fornecida, fez as seguintes afirmações:
I - É possível maximizar a produção de amoníaco se a reação ocorrer a pressões elevadas.
II - Dada a natureza exotérmica da reação direta, quanto menor a temperatura do vaso reacional, maior será a produção de amoníaco.
A alternativa correta é:
a) Apenas a afirmação I está correta.
b) Apenas a afirmação II está correta.
c) Ambas as afirmações estão corretas
d) Ambas as afirmações estão incorretas.
Resolução:
Letra C
A reação apresentada envolve apenas substâncias gasosas, logo a pressão afetará a posição de equilíbrio químico. Perceba que nos reagentes há 1 mol de N2 e 3 mols H2, então existem 4 mols de gases nos reagentes. No lado dos produtos, há apenas 2 mols de gases. Assim, o lado dos reagentes ocupa maior volume do que o lado dos produtos.
Ao aumentar a pressão, a reação é deslocada para o sentido dos produtos (menor volume). Ao reduzir a pressão, o lado dos reagentes é favorecido (maior volume).
Como o valor de variação de entalpia para a reação (ΔH°) é negativo, essa reação é exotérmica e ocorre por meio da liberação de calor. Assim, ao aquecer o sistema, a reação é deslocada para os reagentes (lado endotérmico e que absorve calor). E ao resfriar o sistema, a reação é deslocada para os produtos (lado exotérmico e que libera calor).
Assim, a afirmativa I é correta, pois a reação é deslocada para os produtos (amoníaco) com o aumento de pressão.
A afirmativa II é correta, afinal a reação é, sim, exotérmica. Se realizada em baixa temperatura, o sistema trabalha continuamente para gerar mais calor, deslocando a reação no sentido dos produtos.