A molaridade ou concentração molar (M) é a forma mais usual de expressar a quantidade de matéria de uma substância em solução. A concentração molar é calculada pela razão entre a quantidade de matéria, expressa em mols, e o volume da solução, normalmente dado em litros. Por isso, a concentração molar é expressa em unidade de mol/L. Se o número de mols do soluto não for conhecido, é possível determiná-lo pela razão entre a massa e a massa molar da substância.
Leia também: Densidade de uma solução — a modalidade de concentração que relaciona a massa com o volume
Resumo sobre molaridade ou concentração molar
-
A molaridade ou concentração molar é a forma usual de expressar a quantidade de matéria de uma substância em solução.
-
A concentração molar é a relação matemática entre a quantidade de matéria de um soluto (mol) em determinado volume de solução.
-
A molaridade é calculada pela reação M = n/V, sendo n o número de mols e V o volume de solução.
-
A concentração molar é expressa em mol/L.
-
A quantidade de matéria (n) pode ser encontrada pela razão entre massa (m) e massa molar (MM) de uma substância.
-
A molalidade (W) se difere da molaridade, pois é a relação entre a quantidade de matéria do soluto (mol) e a massa do solvente (kg).
-
A concentração comum (C) se difere da concentração molar (M), pois considera a massa do soluto (em gramas) sobre o volume da solução (em L).
Videoaula sobre concentração molar, concentração em mol/L ou molaridade
O que é molaridade?
A molaridade (M) é uma medida da concentração de uma solução considerando a razão entre a quantidade de matéria de um soluto, em unidades de mol, pelo volume de uma solução, normalmente expressa em litro (L).
Essa medida também é conhecida como concentração molar, concentração em mol/L ou concentração em quantidade de matéria. É a forma mais usual de representar a concentração de soluções.
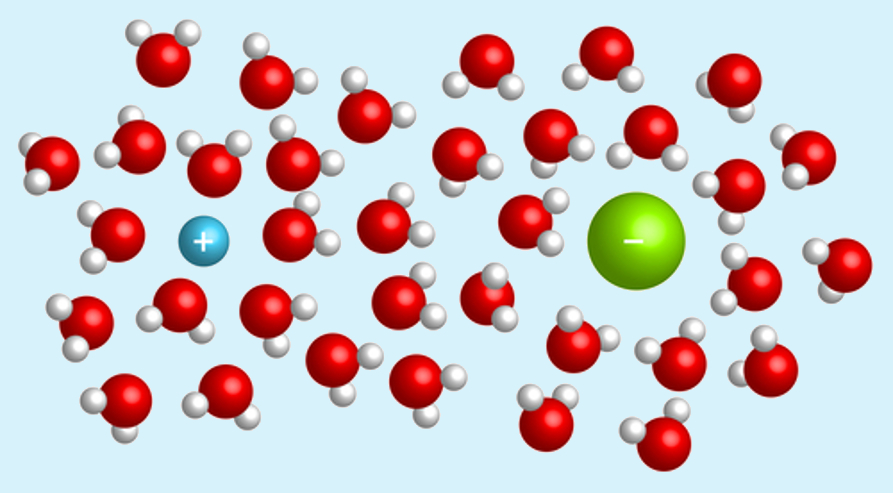
Soluções de maior concentração molar possuem maior quantidade de matéria (moléculas/íons/átomos) por volume de solução em comparação a soluções de menor concentração molar. A imagem abaixo ilustra isso.

Qual a fórmula da molaridade ou concentração molar?
A fórmula para determinar a molaridade ou concentração molar é:
\(\mathbf{M=\frac{n}{V}}\)
-
M → molaridade (em mol/L).
-
n → número de mols do soluto, em unidade de mol.
-
V → volume da solução, em unidade de litro (L).
Outra forma de expressar a relação de molaridade ou concentração molar é usando valores de massa de soluto (m). Nesse caso, é usada a relação de igualdade \(\mathbf{n=\frac{m}{MM}}\), em que MM é a massa molar do soluto:
\(\mathbf{n=\frac{m}{MM \cdot V}}\)
-
M → molaridade (em mol/L).
-
m → massa do soluto (em gramas (g)).
-
MM → massa molar do soluto (em g/mol).
-
V → volume da solução (em L).
Como calcular a molaridade ou concentração molar?
Para calcular a molaridade ou concentração, é necessário utilizar uma de suas fórmulas. Assim, vamos analisar alguns exemplos para entender como são feitos os cálculos.
-
Exemplo 1:
Para a realização de um teste químico, é necessário 0,270 mol de hidróxido de potássio (KOH). Para isso, um analista de laboratório utilizou 600 mL de uma solução de KOH. Qual a concentração molar dessa solução?
Resolução:
O enunciado informa a quantidade de matéria (número de mols) e o volume da solução. Então, para encontrar a concentração molar, basta aplicar a fórmula:
\(\mathbf{M=\frac{n}{V}}\)
\(\mathbf{M=\frac{0,270\ mols}{0,6\ L}}\)
\(\mathbf{M=0,45\ mol/L}\)
Note que o valor de volume foi convertido de mL para L para a aplicação da fórmula.
-
Exemplo 2:
Para a preparação de uma solução de ácido acético, uma massa de 0,50 g dessa substância foi dissolvida em água e o volume completado para 500 mL. Qual a concentração da solução obtida, sabendo que a massa molar do ácido acético é de 60 g/mol?
Resolução:
Nesse exemplo, não foi fornecido o número de mols da substância, mas sim a massa e massa molar. Assim, aplica-se:
\(\mathbf{n=\frac{m}{MM \cdot V}}\)
\(\mathbf{n=\frac{0,50\ g}{60\frac{g}{mol}\cdot0,5\ L}}\)
\(\mathbf{M= 0,020\ mol/L}\)
Portanto, a concentração molar da solução é 0,020 mol/L.
-
Exemplo 3:
Quantos mols de hidróxido de sódio (NaOH) são necessários para a preparação de 800 mL de uma solução em concentração de 0,560 mol/L de NaOH?
Resolução:
Nesse exemplo, são conhecidos os valores de volume e de concentração molar. Então, manipulando a fórmula para a concentração molar, é possível determinar a massa de NaOH:
\(\mathbf{M=\frac{n}{V}}\)
\(\mathbf{n=M\cdot V}\)
\(\mathbf{n=0,560\ \frac{mol}L\cdot 0,8\ L}\)
\(\mathbf{n=0,45\ mol}\)
Portanto, a quantidade de matéria (mol) necessária para o preparo dessa solução é de 0,45 mol de NaOH.
Veja também: Cálculo estequiométrico com mol — como é feito?
Diferenças entre molaridade e molalidade
A molalidade é representada por W e se refere à determinação da concentração de uma solução considerando a relação entre quantidade de soluto (em mol) e massa do solvente (em kg).
\(\mathbf{W=\frac{n}{m_{solvente}}}\)
-
W → molalidade (em mol/kg).
-
n → número de mols do soluto, em unidade de mol.
-
\(m_{solvente}\) → massa do solvente, em quilogramas (Kg).
A molalidade considera o número de mols por massa do solvente, enquanto a molaridade considera o número de mols em relação ao volume da solução.
Diferenças entre molaridade e concentração comum
A concentração comum é representada por C e determina a concentração de uma solução considerando a relação entre a massa de soluto (em gramas) e o volume da solução (em litros).
\(\mathbf{C=\frac{m_{soluto}}{V_{soluc\tilde{a}o}}}\)
-
C → concentração comum, expressa em grama por litro (g/L).
-
\(m_{soluto}\) → massa do soluto, em gramas (g).
-
Vsolução → volume da solução, em litros (L).
A concentração comum considera a massa do soluto por volume da solução, enquanto a molaridade considera o número de mols em relação ao volume da solução.
De acordo com o Sistema Internacional (SI), volume é expresso em m3, logo a concentração comum é expressa em g/m3. No entanto, é comum a utilização da unidade de litros (L) para o volume de solvente, sendo usual a representação da concentração comum em g/L.
Exercícios resolvidos sobre molaridade ou concentração molar
Questão 1
(Ufscar) Soro fisiológico contém 0,900 gramas de NaCℓ, massa molar = 58,5 g/mol, em 10 mL de solução aquosa. A concentração do soro fisiológico, expressa em mol/L, é igual a
A) 0,009
B) 0,015
C) 0,100
D) 0,154
E) 0,900
Resolução:
Alternativa D
Para calcular a concentração do soro fisiológico, usa-se a fórmula que relaciona massa e massa molar, já que não foi fornecido diretamente o número de mols de NaCℓ.
\(\mathbf{M=\frac{0,900\ g}{58,5\ \frac{g}{mol}\cdot \ 0,1\ L}}\)
\(\mathbf{M=0,154\ mol/L}\)
Questão 2
(Vunesp) Com o objetivo de diminuir a incidência de cáries na população, em muitas cidades adiciona-se fluoreto de sódio (NaF) à água distribuída pelas estações de tratamento, de modo a obter uma concentração de 2,0 x 10-5 mol/L. Com base nesse valor e dadas as massas molares em g/mol: Na = 23 e F = 19, podemos dizer que a massa do sal contida em 500 mL dessa solução é:
A) 4,2 x 10-1 g.
B) 8,4 x 10-1 g.
C) 4,2 x 10-4 g.
D) 6,1 x 10-4 g.
E) 8,4 x 10-4 g.
Resolução:
Alternativa C
Para conhecer a massa do sal contida no volume de 500 mL, primeiramente deve-se calcular a massa molar NaF, já que as massas molares de cada átomo são conhecidas.
\(\mathbf{massa\ molar\ (NaF)= massa\ molar\ de\ Na+massa\ molar\ de\ F}\)
\(\mathbf{massa\ molar\ (NaF)=23\ \frac{g}{mol}+19\ \frac{g}{mol}}\)
\(\mathbf{massa\ molar\ (NaF)=42\ \frac{g}{mol}}\)
Agora, é possível aplicar a fórmula da concentração molar, isolando o fator m:
\(\mathbf{n=\frac{m}{MM \cdot V}}\)
\(\mathbf{m=M \cdot (MM)\cdot V}\)
\(\mathbf{m=(2,0\ x\ 10^{-5}\ \frac{mol}{L})\cdot(42\ \frac{g}{mol}) \cdot 0,5\ L}\)
\(\mathbf{m=0,00042\ g=4,2\ x\ 10^{-4}\ g}\)