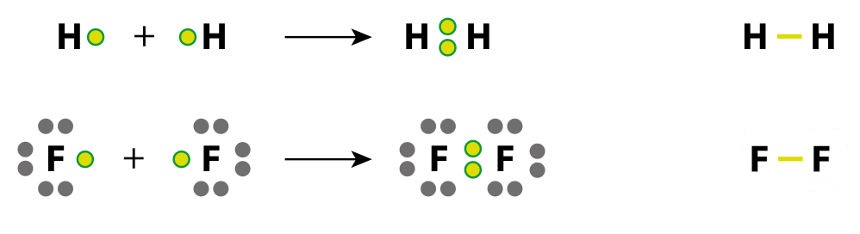
Em nosso cotidiano, várias reações químicas e processos físicos envolvem trocas de energia na forma de calor. Por exemplo, quando queimamos o carvão, temos uma reação química de combustão com liberação de energia na forma de calor. Por outro lado, a fotossíntese é uma reação química em que as folhas da planta absorvem a energia do sol para transformar o gás carbônico e a água em glicose e oxigênio.
O campo que estuda essas trocas de calor nas reações químicas e nas mudanças de estado físico é a Termoquímica.
Existem dois tipos desses processos, que são: endotérmicos e exotérmicos.
-
Processos endotérmicos: São aqueles em que ocorre a absorção de calor. O prefixo endo significa “para dentro”.
Visto que nesses processos a entalpia (energia global simbolizada por H) dos produtos é maior que a entalpia dos reagentes, a variação da entalpia (ΔH) ou o calor envolvido nos processos endotérmicos será sempre um valor positivo. Assim, temos que as equações químicas que simbolizam essas reações são representadas genericamente da seguinte forma:
Reagentes + calor → Produtos
ou
Reagentes → Produtos ΔH > 0
É possível representar as reações endotérmicas por meio de um gráfico de entalpia em função do caminho da reação. Abaixo temos um gráfico desse para uma reação genérica:
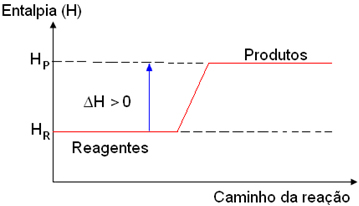
Exemplo genérico de gráfico de processo endotérmico
Por exemplo, a síntese do iodeto de hidrogênio é uma reação endotérmica que pode ser representada da seguinte forma:
1 H2(g) + 1 I2(g) → 2 HI(g) ΔH = + 25,96 kJ/mol
O gráfico dessa reação química seria assim:
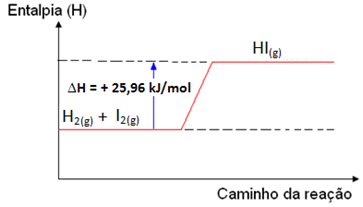
Gráfico da variação de entalpia da síntese do iodeto de hidrogênio
A fotossíntese mencionada é outro exemplo de reação endotérmica. Veja agora mais casos:
- Reações químicas:
- A eletrólise da água produz os gases oxigênio e hidrogênio, que têm maior energia potencial que a água;
- A bolsa de gelo instantâneo contém cápsulas de NH4NO3 e água. Quando se partem essas substâncias, elas misturam-se de forma endotérmica e produzem a sensação de frio;
- Na produção de ferro a partir da hematita ocorre a absorção de 491,5 kJ;
- A decomposição térmica do calcário (CaCO3) para a produção da cal virgem (CaO) é um processo endotérmico, que absorve 178 kJ/mol.

Exemplos de reações endotérmicas: produção de ferro e bolsa de gelo instantâneo
- Mudanças de estado Físico:
- Na evaporação da água, 1 mol dela precisa absorver cerca de 44 kJ para passar do estado líquido para vapor;
- Fusão da água (a quantidade de calor necessária para transformar 1 mol de gelo em água líquida é de 7,3 kJ).

Exemplos de processos endotérmicos: evaporação e fusão
-
Processos exotérmicos: São aqueles em que ocorre liberação de calor. O prefixo exo significa “para fora”.
Nesse caso, como se libera calor, a entalpia dos produtos é menor que a dos reagentes, por isso a variação de entalpia dos processos exotérmicos sempre será negativa:
Reagentes → Produtos + calor
ou
Reagentes → Produtos ΔH < 0
O seu gráfico é representado da seguinte forma:
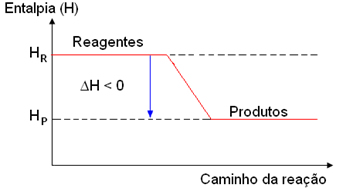
Exemplo genérico de gráfico de processo exotérmico
Por exemplo, a combustão do gás hidrogênio libera para o meio 68,3 kcal por mol de H2 que reage:
1 H2(g) + 1/2 O2(g) → 2 H2O(g) ΔH = -68,3 kcal/mol
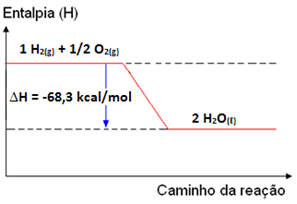
Gráfico da variação de entalpia da combustão do gás hidrogênio
Outros exemplos de reações exotérmicas são:
- Reações químicas:
- Qualquer tipo de queima ou combustão, tais como a da gasolina, álcool e óleo diesel dos automóveis, bem como a queima de papel, gases, entre outros, são exemplos de reações que liberam calor;
- Bolsa de aquecimento: quando o plástico é removido, o ferro em pó reage com o oxigênio do ar e essa reação libera calor durante 5 horas;

Exemplos de reações exotérmicas: combustão da gasolina e queima de carvão
- Mudanças de estado Físico:
- Na solidificação da água, 1 mol de água no estado líquido precisa liberar 7,3 kJ de calor;
- Na condensação da água, a quantidade de calor que 1 mol de vapor deve perder para passar para o estado líquido é 44 kJ.

Exemplos de processos exotérmicos: solidificação e condensação
Videoaulas relacionadas: