A chuva ácida é qualquer forma de precipitação que carregue consigo componentes ácidos, como o ácido sulfúrico e o ácido nítrico. Pode incluir a própria chuva como também neve, neblina, granizo e até mesmo poeira. A chuva comum possui valor de pH em torno de 5,6, considerado levemente ácido. Contudo, atividades que contribuem para a poluição do ambiente promovem acidificação da chuva, reduzindo o pH para valores entre 4,5 e 2,8.
Atividades humanas poluentes são as principais causadoras da chuva ácida, destacando-se a queima de combustíveis fósseis no setor industrial, no transporte e na geração de energia elétrica. As consequências da chuva ácida são verificadas no desequilíbrio do ecossistema aquático, desnutrição do solo com degradação de florestas e áreas plantadas e processos erosivos em construções baseadas em cimento e concreto, como edifícios e monumentos.
Leia também: Destruição da camada de ozônio — uma situação que gera inúmeros impactos ao meio ambiente e à saúde humana
Resumo sobre chuva ácida
-
A chuva ácida é um fenômeno atmosférico de precipitação em elevada acidez, caracterizada pelo baixo valor de pH.
-
Dióxido de enxofre e óxidos de nitrogênio são os principais gases responsáveis por tornar a chuva ácida.
-
A principal fonte natural desses gases são erupções vulcânicas.
-
As atividades humanas são as principais acidificadoras da atmosfera, destacando-se a queima de combustíveis fósseis, como o carvão e derivados de petróleo.
-
Emissões de SO2 e NOx formam ácido sulfúrico e ácido nítrico pela reação química com a água na atmosfera.
-
A chuva ácida desequilibra o ecossistema aquático pela alteração de pH e por proporcionar a permanência de espécies tóxicas na água.
-
As florestas e plantações sofrem pela perda de nutrientes do solo em razão da chuva ácida.
-
Construções, edifícios e monumentos sofrem erosão pela chuva ácida.
Características da chuva ácida
A chuva ácida possui esse nome em razão de seu baixo valor de pH em comparação à chuva comum. Aquela é formada por ácido sulfúrico e ácido nítrico, gerados na atmosfera, os quais atuam na redução do pH da chuva para níveis abaixo de 5, tornando-a ácida.
Esses ácidos derivam da transformação química de óxidos, liberados na atmosfera por processos naturais, como ação dos vulcões, mas principalmente pela ação humana desencadeada pela queima de combustíveis fósseis.
Quais são as causas da chuva ácida?
Também chamada de precipitação ácida, a chuva ácida acontece principalmente pela emissão de determinados gases para a atmosfera, o dióxido de enxofre (SO2) e os diferentes óxidos de nitrogênio (NOx).
A emissão desses gases provém de processos naturais e de atividades humanas, as quais tornam a chuva ainda mais ácida em decorrência da formação de espécies como o ácido sulfúrico e o ácido nítrico.
O alcance da chuva ácida não é apenas regional, podendo ser ampliado pelo transporte dos compostos ácidos através de correntes de ar.
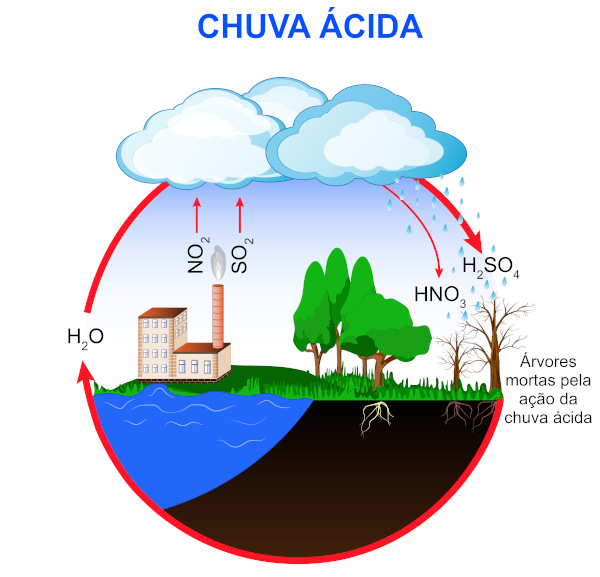
Origem da chuva ácida
A chuva ácida ocorre pela emissão de alguns óxidos para a atmosfera. As atividades emissoras de tais óxidos podem ser de fontes naturais ou antropogênicas (derivadas da ação humana).
As precipitações comuns são levemente ácidas, registrando valores de pH em torno de 5,6. A emissão de gases poluentes para a atmosfera promove a formação de substâncias químicas que tornam a chuva mais ácida, reduzindo seus valores de pH para menos de 4,5, podendo chegar a 2,8 em algumas regiões.
As erupções vulcânicas são uma fonte natural de acidificação da chuva. Estima-se que vulcões podem emitir de 50 a 70 milhões de toneladas de enxofre anualmente. O elemento enxofre (S) reage com a água, formando o ácido sulfúrico.

Outras situações são atividade microbiológica, relâmpagos e queimas naturais de biomassa, as quais são fontes de nitrogênio, que também pode reagir com água e formar diferentes óxidos de nitrogênio, os quais contribuem para a redução do pH das chuvas.
No entanto, as emissões causadas pelas atividades humanas (fontes antropogênicas) são as maiores causadoras da acidificação da atmosfera. A queima de combustíveis fósseis, como o carvão e derivados de petróleo, é a principal atividade emissora de gases ácidos para o ambiente e ocorre em larga escala no setor industrial e de transportes.

Estimativas apontam que o modo de vida moderno é responsável pela emissão de mais de 100 milhões de toneladas de SO2 e cerca de 70 milhões de toneladas de óxidos de nitrogênio todos os anos.
Como a chuva ácida é formada?
A formação da chuva ácida ocorre pela emissão dos gases SO2 e NOx para a atmosfera, os quais entram em contato com água, oxigênio e outros produtos químicos, gerando os ácidos sulfúrico (H2SO4) e nítrico (HNO3) por meio de reações químicas. Atividades que emitam enxofre ou nitrogênio também geram os mesmos ácidos.
A chuva já é levemente ácida em razão da presença do dióxido de carbono (CO2) na atmosfera, o qual interage com água, formando o ácido carbônico (H2CO3):
\(CO_2 (g)+ H_2 O\ (l) \longrightarrow H_2 CO_3\ (aq)\)
Atividades que emitam óxidos de enxofre ou o próprio enxofre para o ambiente são responsáveis pela formação do ácido sulfúrico por meio das seguintes reações químicas:
\(S (s)+ O_2\ (g) \longrightarrow SO_2\ (g)\)
\(2\ SO_2 (g)+ O_2\ (g) \longrightarrow 2\ SO_3\ (g)\)
\(SO_3\ (g)+H_2\ O\ (l) \longrightarrow \color{red}{H_2 SO_4}\ (aq)\)
Processos responsáveis por emissões de gás nitrogênio também contribuem para a acidificação da chuva, pois geram diferentes óxidos de nitrogênio, genericamente representados por NOx. O termo x se refere à possibilidade de diferentes combinações entre o oxigênio e o nitrogênio. Por exemplo:
\(N_2 \ (s)+2\ O_2\ (g) \longrightarrow 2\ NO_2\ (g)\)
\(2\ NO_2\ (g)+H_2 O\ (l) \longrightarrow \color{red}{HNO_2}\ (aq)+ \color{red}{ HNO_3}\ (aq)\)
Consequências da chuva ácida
As consequências da chuva ácida afetam o meio ambiente e a saúde humana. É comum que a chuva ácida seja registrada em regiões próximas às grandes cidades ou setores industriais. Contudo, correntes de ar podem carregar as substâncias ácidas para regiões menos poluídas, como florestas.
Os maiores impactos ecológicos da chuva ácida são observados no ambiente aquático, como rios, lagos, pântanos e no mar. Nesses ambientes, a vegetação e os animais vivem em uma condição de acidez ideal. Alterações nos valores de pH podem interferir na atividade de enzimas e microrganismos, prejudicando processos biológicos e de reprodução.
![Placa indicando que um rio está morrendo devido à ocorrência de chuva ácida na região. [1]](https://static.manualdaquimica.com/2023/02/placa-chuva-acida.jpg)
Em ambientes aquáticos, uma severa alteração causada pela chuva ácida é a liberação de íons metálicos de alumínio e de mercúrio, os quais são altamente tóxicos para os animais e plantas.
Ao chegar no solo e se infiltrar, a precipitação ácida pode causar a dissolução de partículas de alumínio em razão do baixo valor de pH, carregando esse metal para cursos de água, desequilibrando o ecossistema aquático.
Em regiões de florestas, lavouras e plantas em geral, a chuva ácida é prejudicial por interagir com nutrientes e minerais do solo, carregando-os consigo e tornando o solo pobre. Com isso, a saúde e crescimento das plantas é prejudicado, bem como todo o ecossistema do entorno daquela região, que necessita da vegetação para alimentação e proteção.

A precipitação ácida também pode afetar estruturas construídas pelo homem, como construções, edifícios, pontes e estátuas. Essas construções geralmente possuem carbonato de cálcio (CaCO3), que é um componente do cimento e que se converte em água e gás carbônico em ambiente ácido, acabando por causar um tipo de erosão em tais estruturas.
Veja também: Qual é o pH do solo?
Chuva ácida no Brasil
No Brasil, os efeitos mais marcantes de chuva ácida foram registrados na cidade de Cubatão, São Paulo, nos anos 80. A cidade reunia um grande polo industrial, com indústrias de petróleo, metalúrgicas, fertilizantes etc. Na época, não havia legislação para regularizar a atividade dessas empresas nem monitoramento sobre a quantidade das emissões atmosféricas.
A cidade foi considerada pela Organização das Nações Unidas a cidade mais poluída do mundo. Foram registrados danos à Mata Atlântica que recobria a serra do mar, com muitas regiões com devastação e seca da vegetação, dificuldade de respiração e casos de irritação ocular e pulmonar na população. Na época, ao menos 37 crianças nasceram mortas, por problemas de anencefalia (falta do cérebro).
Em 1992, a cidade foi reconhecida como símbolo da recuperação ambiental após várias medidas para redução da chuva ácida pelo controle das emissões industriais.
Outras regiões do país também já registraram chuva ácida, como a Zona Franca de Manaus, importante polo industrial do país, assim como regiões com grande concentração de fábricas e de veículos.
Chuva ácida no mundo
Diversas regiões do mundo registram, ou já registraram, elevados índices de chuva ácida. Veja a seguir algumas situações:
-
A região da República Tcheca, Alemanha e Polônia ficou conhecida como Triângulo Negro nas décadas de 1970 e 1980, em decorrência da alta incidência de poluição e registros de chuva ácida. Muitas florestas foram danificadas e até mesmo trilhos de trem estavam sendo corroídos pela precipitação ácida. As indústrias que empregavam queima de carvão na Europa Oriental ficaram sob estrita vigilância com a Convenção de Genebra (1979), na tentativa de conter as emissões ácidas na região.
-
Nos Estados Unidos, a grande expansão industrial nos anos 70 gerou uma série de episódios de chuva ácida e danos ambientais. Até hoje, algumas áreas de Nova Jersey possuem quase 90% de seus riachos de água doce com elevado índice de acidez.
-
Na Ásia, a urgência em controlar a chuva ácida é uma demanda atual. Desde o ano 2000, os níveis de SO2 e NOx nas chuvas têm aumentado constantemente em cidades como Pequim e Nova Deli, à medida que a demanda doméstica por eletricidade e produtos manufaturados também se eleva.
Crédito de imagem
[1] Joseph Sohm / Shutterstock