No texto Ligação Covalente, vimos que esse tipo de ligação química ocorre quando há o compartilhamento de pares de elétrons entre átomos de hidrogênio, ametais e semimetais. Agora veremos um tipo especial de ligação covalente, a ligação covalente dativa, também chamada de ligação covalente coordenada.
Essa ligação também ocorre com o compartilhamento de pares de elétrons, porém, a diferença é que, na ligação covalente normal, os elétrons são provenientes dos átomos dos dois elementos, já na ligação covalente dativa, os elétrons são provenientes somente de um dos átomos.
Em relação à localização na Tabela Periódica, os ametais e semimetais que realizam ligações covalentes normais e dativas poderão realizar, no máximo, as seguintes ligações:

Possibilidade de realização de ligação covalente dativa dos ametais e semimetais principais da Tabela Periódica
Esse tipo de ligação ocorre com moléculas muito importantes estudadas na Química Inorgânica, como os óxidos ácidos (anidridos) e os óxiácidos (ácidos que possuem o oxigênio em sua constituição).
Vejamos alguns exemplos de ligações covalentes dativas:
* SO2: Dióxido de enxofre (gás sulfuroso):
O oxigênio e o enxofre são ambos da família 16, o que significa que eles possuem seis elétrons na camada de valência e precisam receber mais dois elétrons (segundo a regra do octeto) para ficar estáveis. Observe a seguir que primeiro o enxofre liga-se a um dos átomos de oxigênio, realizando duas ligações covalentes normais, ou seja, compartilham dois pares de elétrons, ficando ambos estáveis:
![]()
Formação da ligação covalente normal entre o oxigênio e o enxofre
No entanto, ainda temos o outro oxigênio que não está estável e também precisa receber dois elétrons. O enxofre, que é o elemento central, possui dois pares de elétrons disponíveis, assim ele cede um de seus pares para o oxigênio por meio de uma ligação covalente dativa, que é indicada por uma seta que vai em direção ao átomo que utiliza o par eletrônico do outro:

Exemplo do dióxido de enxofre de ligação dativa
* SO3: Trióxido de enxofre (anidrido sulfúrico):
Nessa molécula ocorre as mesmas ligações mostradas para o SO2, mas como o enxofre possui ainda mais um par de elétrons disponível, ele pode ainda realizar mais uma ligação covalente dativa com outro átomo de oxigênio:
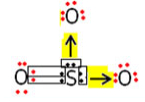
Exemplo do trióxido de enxofre que possui duas ligações dativas
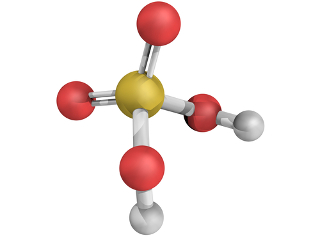
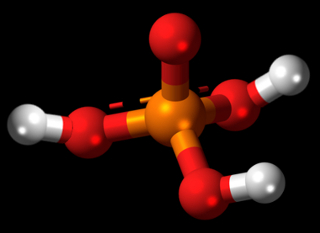
* H2SO4: Ácido sulfúrico:
Lembre-se: Sempre que você for escrever a fórmula de oxiácidos, o hidrogênio virá ligado ao átomo de oxigênio, que, por sua vez, estará ligado ao átomo central, e os átomos de oxigênio restantes completarão as ligações do átomo central.
No caso do H2SO4, ele possui dois hidrogênios que se ligam cada um a um átomo de oxigênio, que, por sua vez, está ligado ao átomo central, que é o enxofre:
![]()
Formação das ligações covalentes normais que iniciam a formação do ácido sulfúrico
Desse modo, todos estão estáveis, com oito elétrons na camada de valência (e dois elétrons, no caso do hidrogênio que possui somente uma camada eletrônica). Mas no ácido sulfúrico ainda existem mais dois átomos de oxigênio. Visto que o enxofre ainda possui dois pares de elétrons disponíveis, ele realiza duas ligações dativas, uma ligação dativa com cada oxigênio:
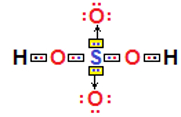
No ácido sulfúrico, ocorrem duas ligações dativas
Aproveite para conferir nossas videoaulas relacionadas ao assunto: