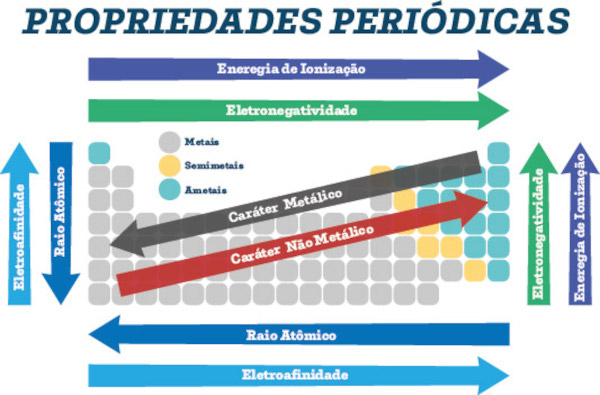
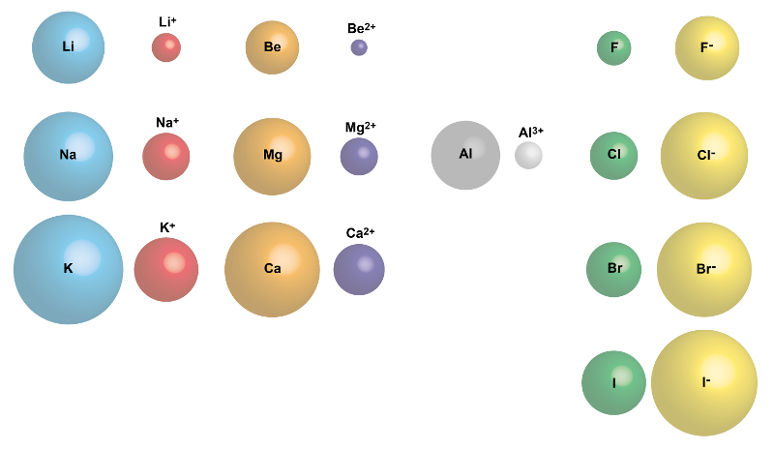
As propriedades periódicas são características dos elementos químicos que se repetem em intervalos regulares ao longo da tabela periódica. Sendo assim, elas servem como um guia para entendermos as tendências de comportamento dos elementos, bem como suas formas de interação, seja para formar ligações químicas ou rompê-las, ou ainda ajudar na compreensão das propriedades físico-químicas das substâncias. Desse modo, alguns exemplos dessas propriedades incluem o raio atômico, a eletronegatividade, a afinidade eletrônica e a energia de ionização.
Leia também: Tabela periódica — organização sistematizada das espécies atômicas descobertas
Resumo sobre propriedades periódicas
- Propriedades periódicas são características dos elementos químicos que variam de forma previsível na tabela periódica.
- Algumas das principais propriedades periódicas incluem raio atômico, energia de ionização, afinidade eletrônica e eletronegatividade.
- O raio atômico tende a diminuir ao longo de um período e aumentar ao descer em um grupo da tabela periódica.
- A energia de ionização e a afinidade eletrônica tendem a aumentar ao longo de um período e diminuir ao descer em um grupo.
- A eletronegatividade tende a aumentar ao longo de um período e diminuir ao descer em um grupo.
- A eletropositividade aumenta da direita para a esquerda ao longo de um período e tende a diminuir ao subir em um grupo.
O que são as propriedades periódicas?
As propriedades periódicas são tendências ou padrões observados nos elementos químicos da tabela periódica. Portanto, essas propriedades variam de forma previsível ao longo das fileiras (períodos) e colunas (grupos) da tabela periódica. Sendo assim, vale ressaltar que essas propriedades são úteis para prever o comportamento dos elementos e suas reações químicas com base em sua posição na tabela periódica.
Principais propriedades periódicas
As principais propriedades periódicas são: raio atômico, energia de ionização, afinidade eletrônica, eletronegatividade e eletropositividade. Falaremos um pouco mais sobre cada uma delas a seguir.
→ Raio atômico
O raio atômico é a distância média do núcleo de um átomo até a sua camada mais externa de elétrons. Nesse caso, trata-se da média obtida pela distância entre dois núcleos atômicos de átomos do mesmo elemento, conforme pode ser visto a seguir:
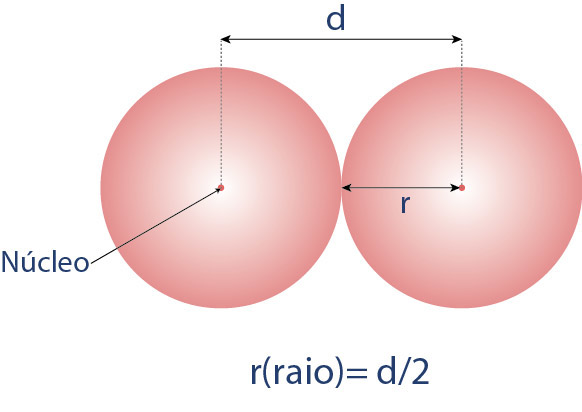
Uma vez sabendo o que é raio atômico, podemos descobrir sua tendência periódica, que consiste em diminuir ao longo de um período (da esquerda para a direita) da tabela periódica devido ao aumento da carga nuclear efetiva, que atrai os elétrons mais próximos do núcleo. Por outro lado, tende a aumentar ao descer em um grupo devido à adição de camadas de elétrons mais externas. Diante disso, veja a seguir, de forma simplificada, como ocorre a variação do raio atômico para os elementos representativos (famílias 1A – 7A):
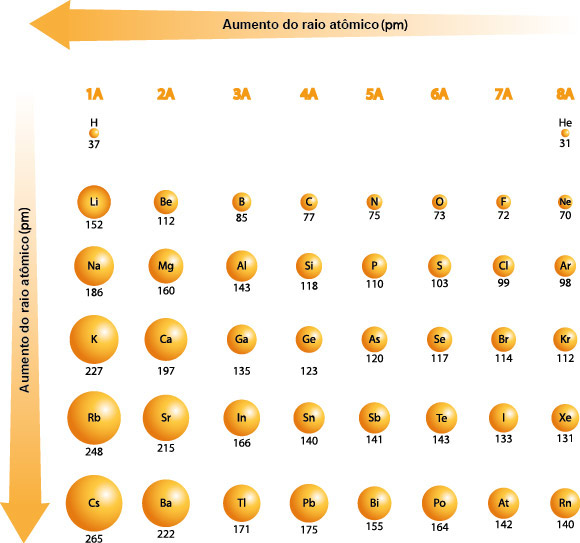
Para saber mais detalhes sobre o raio atômico, clique aqui.
→ Energia de ionização
A energia de ionização é a quantidade de energia necessária para remover um elétron de um átomo gasoso neutro no estado fundamental, conforme ilustrado abaixo:
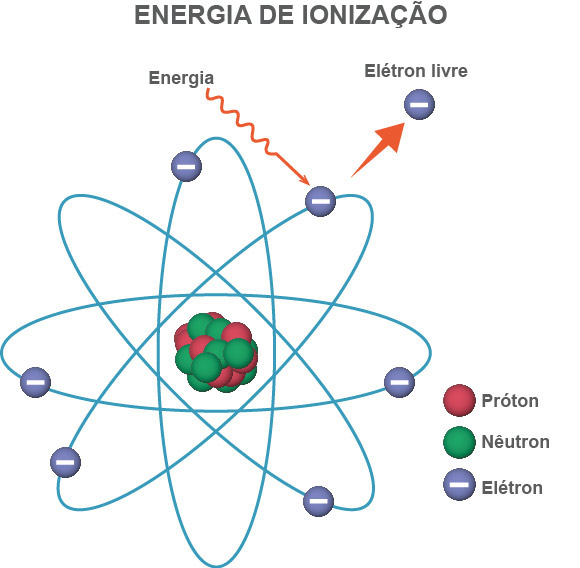
Nesse sentido, ela tende a aumentar ao longo de um período (da esquerda para a direita) na tabela periódica devido ao aumento da carga nuclear efetiva, que torna mais difícil remover um elétron. Por outro lado, ao descer em um grupo, a energia de ionização tende a diminuir devido à maior distância entre os elétrons de valência e o núcleo.
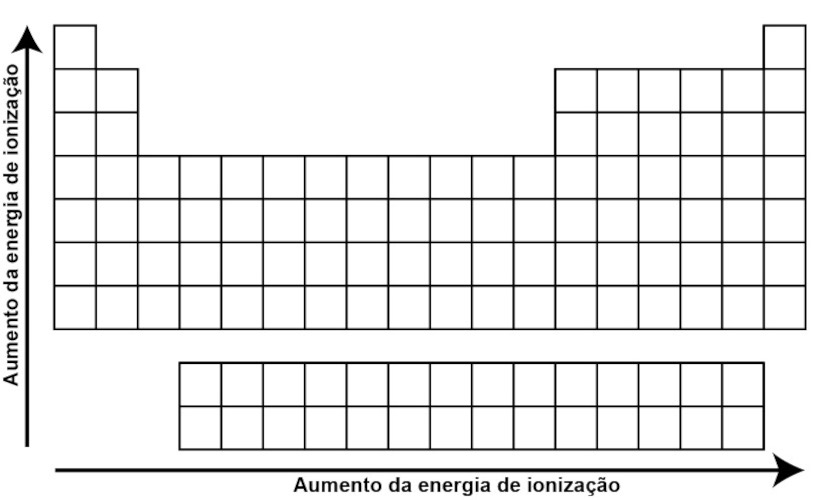
Para saber mais detalhes sobre a energia de ionização, clique aqui.
→ Afinidade eletrônica ou eletroafinidade
Afinidade eletrônica ou eletroafinidade é a energia liberada quando um átomo neutro, gasoso, ganha um elétron para se tornar um íon negativo. Nesse caso, assim como a energia de ionização, ela tende a aumentar da esquerda para a direita ao longo de um período, devido à maior carga nuclear efetiva, o que torna mais fácil para o átomo ganhar um elétron. Já ao descer em um grupo, ela geralmente diminui devido ao aumento do raio atômico e à menor estabilidade dos elétrons adicionais.
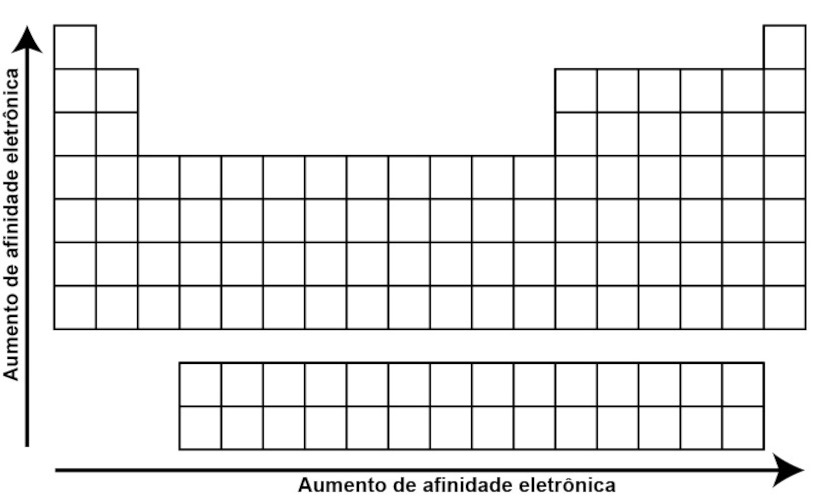
Para saber mais detalhes sobre afinidade eletrônica ou eletroafinidade, clique aqui.
→ Eletronegatividade
Eletronegatividade é a capacidade de um átomo de atrair elétrons para si mesmo quando está ligado a outro átomo. Nesse sentido, ela tende a aumentar da esquerda para a direita ao longo de um período, devido ao aumento da carga nuclear efetiva. Todavia, ela tende a diminuir ao descer em um grupo, devido ao aumento do raio atômico e à menor atração dos elétrons de valência pelo núcleo.
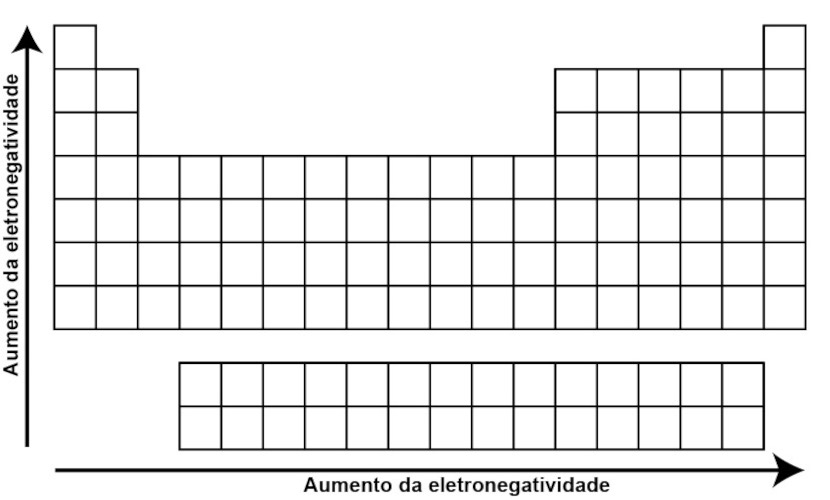
Para saber mais detalhes sobre a eletronegatividade, clique aqui.
→ Eletropositividade
Eletropositividade é uma propriedade química relacionada à tendência de um átomo em perder elétrons e formar íons positivos (cátions) durante uma reação química. Nesse caso, é o oposto da eletronegatividade, que é a capacidade de um átomo de atrair elétrons. Ou ainda, quanto menor a energia de ionização de um átomo, maior sua eletropositividade, pois é mais fácil para esse átomo perder elétrons e se tornar um cátion.
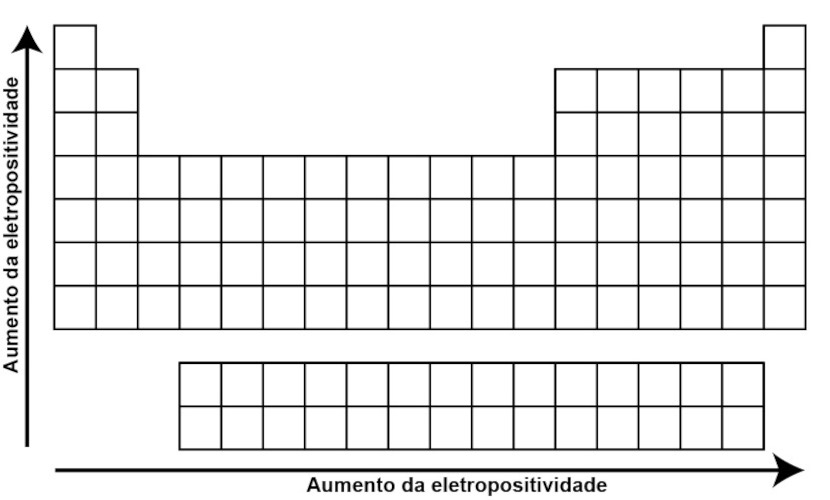
Na tabela periódica, ela tende a aumentar ao descer em um grupo e a diminuir ao longo de um período da direita para a esquerda. Isso ocorre devido às variações na estrutura eletrônica dos átomos e na carga nuclear efetiva. Ao descer em um grupo, os átomos têm mais camadas de elétrons, o que resulta em uma maior distância média entre os elétrons de valência e o núcleo. Isso faz com que os elétrons de valência sejam menos firmemente mantidos pelo núcleo e, portanto, mais facilmente removidos para formar íons positivos, aumentando a eletropositividade.
Para saber mais detalhes sobre a eletropositividade, clique aqui.
Diferenças entre propriedades periódicas e propriedades aperiódicas
As propriedades periódicas e aperiódicas são características dos elementos químicos que variam de maneiras diferentes na tabela periódica. Nesse contexto, destacamos no quadro abaixo as principais diferenças entre elas:
|
Propriedades |
Variação |
Causas |
Exemplos |
Tendências |
|
Propriedades periódicas |
Variam de forma sistemática. |
Geralmente são influenciadas pela estrutura eletrônica dos átomos e distribuição dos elétrons nos orbitais. |
Raio atômico, energia de ionização, afinidade eletrônica, eletronegatividade e eletropositividade. |
Seguem padrões definidos na tabela periódica (aumentam ou diminuem ao longo dos períodos e grupos). |
|
Propriedades aperiódicas |
Não variam de forma sistemática. |
Variações podem ser devido a diversos fatores, como tamanho do núcleo ou número de elétrons. |
Massa atômica, dureza, calor específico e índice de refração. |
Não seguem padrões definidos na tabela. |
Em síntese, as propriedades periódicas são aquelas que variam de forma previsível, enquanto as propriedades aperiódicas são características que não seguem um padrão específico e não variam de maneira sistemática ao longo da tabela periódica.
Exercícios resolvidos sobre propriedades periódicas
Questão 1
(PUC) Em relação às propriedades periódicas dos elementos e suas consequências, é correto afirmar que
A) O flúor possui maior eletronegatividade que o carbono. Logo, os elétrons envolvidos em uma ligação covalente C-F estão deslocados em direção ao átomo de carbono.
B) O raio atômico do cloro é maior que o do iodo.
C) Os metais alcalinos e alcalino-terrosos possuem, em geral, baixa eletronegatividade quando comparados aos elementos halogênios.
D) Os halogênios tendem a formar cátions preferencialmente.
E) O sódio e o lítio possuem alta afinidade eletrônica e por isso formam ânions.
Resolução:
Alternativa C.
A eletronegatividade aumenta da esquerda para a direita e de cima para baixo na tabela periódica. Os metais alcalinos e alcalinoterrosos formam o primeiro e segundo grupo respectivamente, enquanto os halogênios formam o grupo 17. Logo, os halogênios são mais eletronegativos pois se encontram mais à esquerda na tabela.
Questão 2
(Idecam - adaptada) Propriedades periódicas são aquelas definidas na tabela periódica, conforme a variação do número atômico (Z) dos elementos químicos. Sobre o tema, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A eletronegatividade diminui no período da esquerda para a direita e na família de baixo para cima.
( ) A eletroafinidade aumenta no período da esquerda para a direita e na família de cima para baixo.
( ) A energia de ionização diminui no período da direita para a esquerda e na família de cima para baixo.
A sequência está correta em
A) V, V, V.
B) V, F, F.
C) F, V, V.
D) V, V, F.
E) F, F, V.
Resolução:
Alternativa E.
As três propriedades apresentadas aumentam da esquerda para a direita e de baixo para cima. Logo,
(F) – A eletronegatividade AUMENTA no período da esquerda para a direita e na família de baixo para cima.
(F) – A eletroafinidade aumenta no período da esquerda para a direita e na família de BAIXO para CIMA.
(V) – A energia de ionização diminui no período da direita para a esquerda e na família de cima para baixo.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. A periodicidade. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 51–60.
BROWN, T. L. et al. Propriedades periódicas dos elementos. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 270–286.
KORCHEF, A. Periodic Table of Elements and Properties of Atoms. In: Understanding General Chemistry. [s.l: s.n.].
MOSHER, M.; KELTER, P. Periodic Properties of the Elements. In: An Introduction to Chemistry. [s.l: s.n.]. p. 291–337.