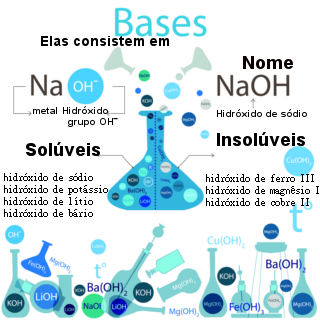
Base é uma classificação dada às substâncias inorgânicas que, em contato com a água, sofrem dissociação, liberando íons hidroxila (-OH-), de acordo com a teoria ácido-base de Arrhenius.
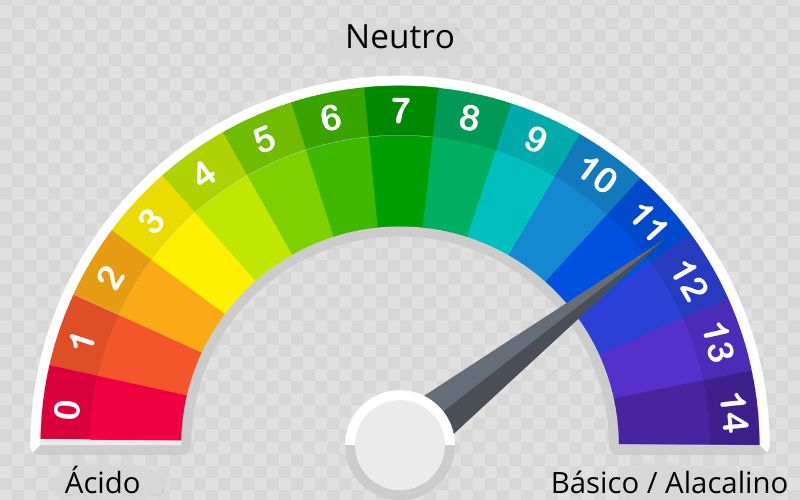
Ao sofrer a dissociação, a base aumenta a concentração de íons OH- no meio. A quantidade desses íons pode ser associada com a acidez/basicidade de soluções, sendo que valores de pH acima de 7 indicam soluções básicas.
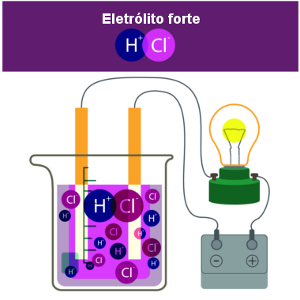
As bases são compostos iônicos e formam soluções eletrolíticas. Sua característica marcante é o sabor adstringente. Algumas bases são altamente corrosivas, sendo agressivas aos olhos, pele e mucosas. Em contato com ácidos, as bases reagem por reação de neutralização, formando sal e água como produtos.
Leia também: Hidretos — substâncias binárias formadas por hidrogênio
Resumo sobre bases
- Bases são um conjunto de compostos iônicos que sofrem dissociação em água, liberando íons hidroxila (OH-), de acordo com a teoria de Arrhenius.
- Na dissociação em água, as bases aumentam a concentração de íons [OH-].
- Soluções básicas são caracterizadas por valor de pH acima de 7.
- As bases possuem sabor adstringente, formam soluções eletrolíticas e são altamente corrosivas.
- Bases reagem com ácidos, formando sal e água por meio de uma reação de neutralização.
Videoaula sobre bases
O que são as bases?
As bases são um conjunto de substâncias inorgânicas que, em contato com a água, formam o ânion hidroxila (-OH-). Na realidade, base é uma classificação atribuída a algumas substâncias inorgânicas de acordo com o seu comportamento químico. Elas também podem ser denominadas álcalis.
Com os avanços da ciência ao longo do tempo, foram desenvolvidas diferentes teorias para justificar o comportamento de substâncias químicas. De acordo com a teoria ácido-base de Arrhenius, as bases são compostos iônicos que sofrem dissociação em água. As moléculas do solvente interagem com os íons, rompendo as interações eletrostáticas que os mantêm unidos e separando-os. Assim, uma base se dissocia em solução aquosa, liberando os íons OH‑.
Veja a representação desse processo para as bases hidróxido de sódio (NaOH) e hidróxido de cálcio (Ca(OH)2):
\(NaOH (s) ^{ H_2O}_\rightarrow\ \ {Na}^+\left(aq\right)+{OH}^-(aq)\ \)
\(Ca(OH)_2(s) ^{ H_2O}_\rightarrow\ {Ca}^{2+}\left(aq\right)+2{OH}^-\left(aq\right)\)
A imagem abaixo ilustra a dissociação do NaOH em água.
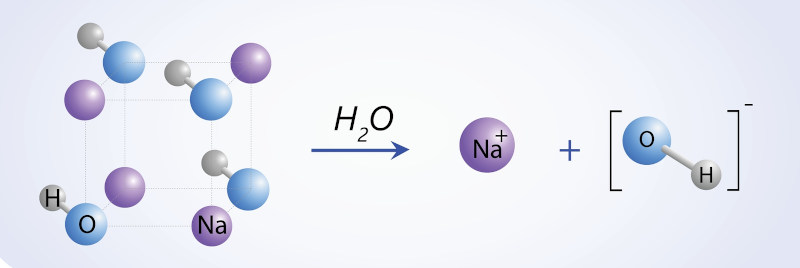
Perceba, pelas equações acima, que o efeito das bases é aumentar a concentração de íons hidroxila na solução.
A teoria de Arrhenius foi desenvolvida, em 1887, pelo cientista Svante Arrhenius e se baseia na natureza das espécies formadas quando um composto é misturado à água. É conhecida também como teoria da dissociação iônica, pois Arrhenius verificou que soluções aquosas de compostos iônicos são capazes de conduzir corrente elétrica. Arrhenius recebeu o Prêmio Nobel de Química em 1903 pela sua teoria ácido-base.
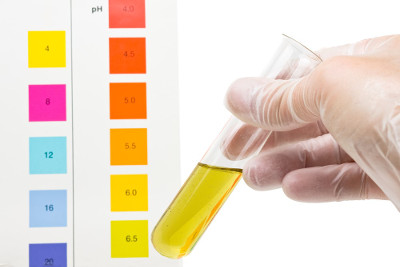
Uma forma de identificar soluções básicas é pela avaliação do potencial hidrogeniônico (pH). Na escala de pH, as bases registram valor entre 7 e 14.
Propriedades das bases
A adstringência é uma característica marcante de substâncias básicas. Você já comeu uma banana verde ou alguma fruta que ainda não estava bem madura? Aquele sabor característico, que dá a sensação de que “amarra a boca”, é denominado adstringência.
As bases são compostos iônicos cujos átomos se mantêm unidos por interações iônicas muito fortes, em razão disso, possuem elevados pontos de fusão e de ebulição.
Algumas soluções básicas têm alto poder corrosivo e são tão agressivas à pele e às mucosas como os ácidos. Soluções aquosas básicas são eletrolíticas, isto é, são capazes de conduzir corrente elétrica, pois são formadas por íons em solução.

As bases reagem com ácidos, em uma reação de neutralização. Em água, as bases formam íons OH-, tornando o pH maior do que 7 (alcalino). Os ácidos liberam íons H+, reduzindo o valor de pH da solução para valores abaixo de 7. Assim, ao reagir quantidades estequiométricas de uma solução básica e ácida, obtém-se como produtos sal e água, em solução neutra com valor de pH igual a 7.
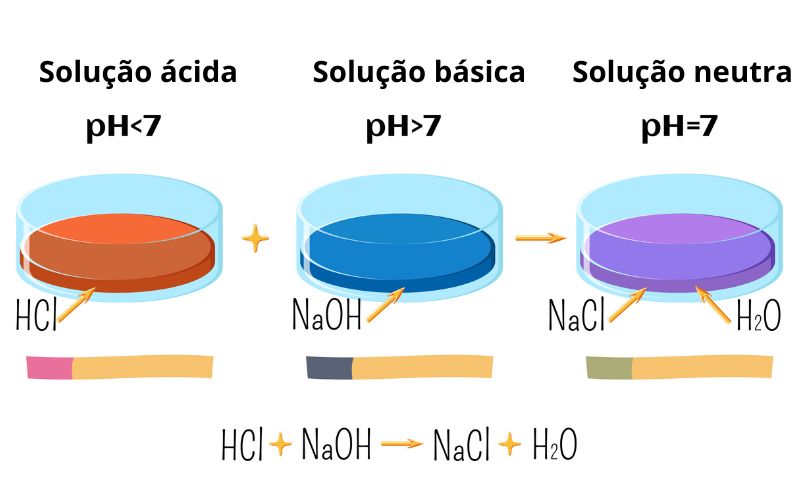
Soluções básicas têm a propriedade de elevar o pH de soluções pelo fato de liberar íons OH-, que, conforme a reação de neutralização, consomem íons H+, tornando o meio reacional menos ácido.
A alteração do valor de pH de soluções pode ser identificada pelo uso de indicadores ácido-base. As bases têm a capacidade de alterar a coloração de soluções que contenham tais substâncias indicadoras, pois reagem com elas por meio de processos de protonação/desprotonação.
A fenolftaleína é uma molécula que funciona como indicador ácido-base, mantendo-se incolor em soluções com valor de pH abaixo de 7, e adquire coloração rosa quando o pH da solução aumenta e se torna básico, ou seja, acima de 7.

Classificação das bases
As substâncias básicas são classificadas conforme a quantidade de grupos hidroxila dissociáveis, em relação à sua força e solubilidade.
-
Classificação das bases de acordo com a quantidade de grupos hidroxila dissociáveis
A quantidade, em mols, de íons OH- liberados na dissociação da base está associada ao número de grupos OH presentes na molécula:
- Monobases possuem uma única hidroxila dissociável, como o hidróxido de potássio (KOH).
- Dibases possuem dois grupos hidroxila para sofrer a dissociação, como o hidróxido de bário (Ba(OH)2).
- Tribases possuem três hidroxilas dissociáveis, como o hidróxido de alumínio (Fe(OH)3).
• Força das bases
A força de uma base é definida de acordo com o grau de dissociação (α), que considera a quantidade de moléculas que efetivamente se dissociam em meio aquoso:
\(\alpha=\frac {n\acute{u}mero de mol\acute{e}culas dissociadas}{n\acute{u}mero de mol\acute{e}culas dissolvidas}\)
Essa relação significa que, ao colocar 100 moléculas de uma base em água e ocorrer a dissociação de 20 delas, o valor calculado de α será de 0,2 (α = 20/100 = 0,2).
Ao multiplicar o valor de α por 100, obtém-se o valor de grau de dissociação em porcentagem, podendo ser feita a seguinte classificação:
• Bases fortes: possuem α maior que 5% (α > 0,5).
O hidróxido de sódio (NaOH) possui α = 95%, isso significa que, de 100 moléculas, 95 delas se dissociam em água, liberando íons OH-. As outras 5 se mantêm como NaOH.
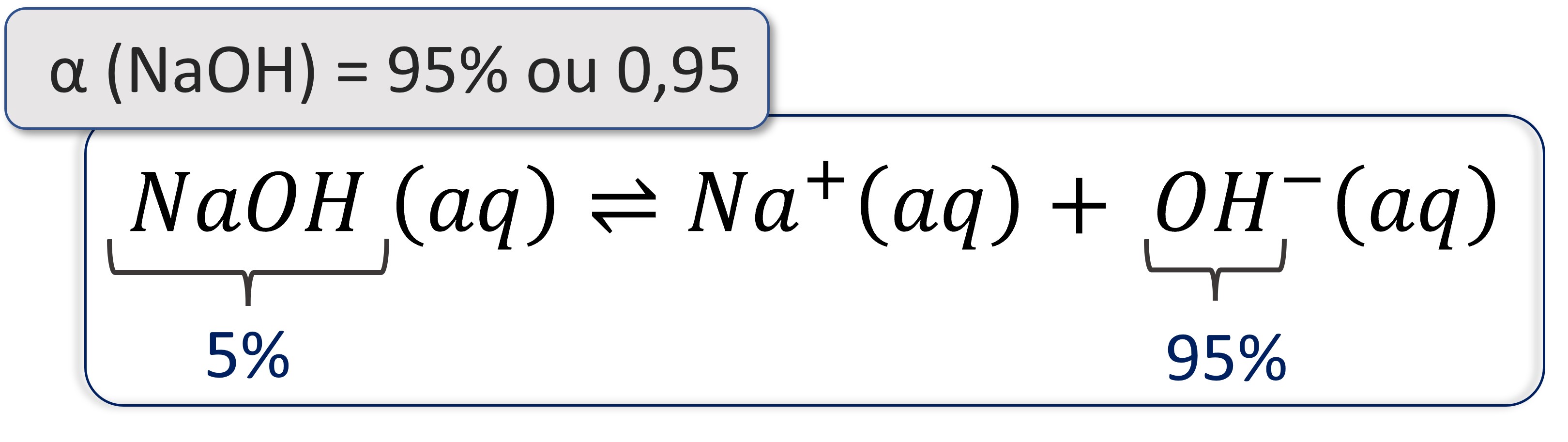
Bases de metais alcalinos (grupo 1) e metais alcalino-terrosos (grupo 2) são bases fortes, com exceção do hidróxido de magnésio (Mg(OH)2).
• Bases fracas: possuem α menor que 5% (α ≤ 0,5).
O hidróxido de amônio (NH4OH) possui α = 1,5%, significando que de, 100 moléculas dessa base, menos de duas delas efetivamente se dissociam em água.
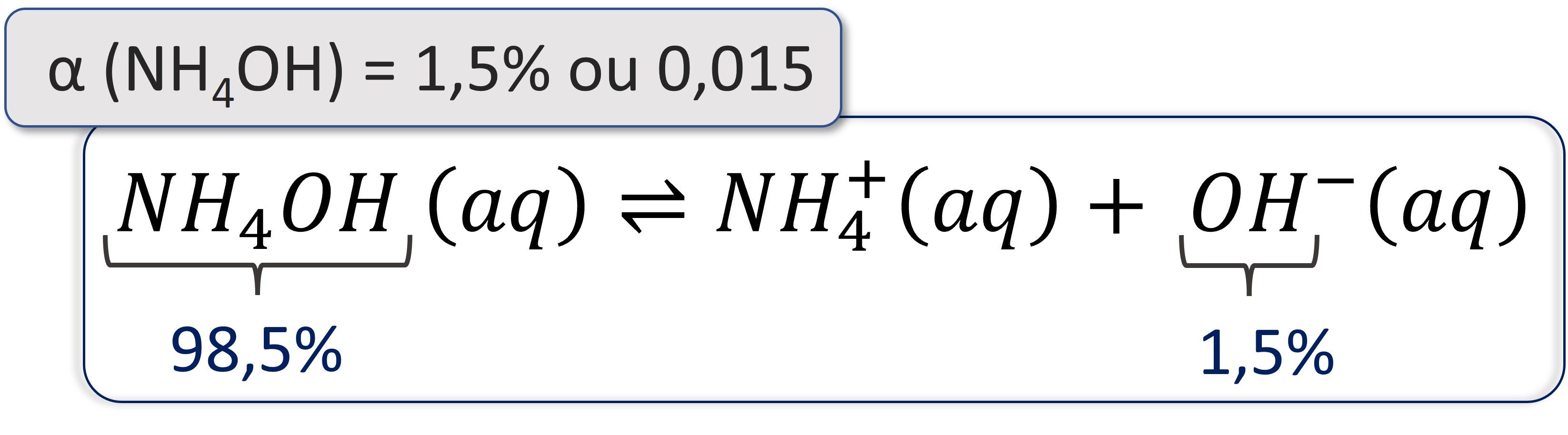
Além do hidróxido de amônio, as bases dos metais pertencentes aos grupos 13, 14 e 15 são consideradas bases fracas.
-
Solubilidade das bases
A solubilidade das bases depende da natureza do metal ligado ao grupo hidroxila. É importante saber reconhecer à qual grupo da Tabela Periódica o metal ligante pertence.
- Bases solúveis: apresentam uma ótima capacidade de se solubilizar em água. São formadas por metais alcalinos (grupo 1) e pelo cátion amônio (NH4+).
- Algumas bases solúveis são:
-
-
- hidróxido de sódio (NaOH);
- hidróxido de potássio (KOH);
- hidróxido de lítio (LiOH).
-
- Bases pouco solúveis: apresentam pequena capacidade de solubilização em água. São constituídas por metais alcalino-terrosos (grupo 2).
- Algumas bases pouco solúveis são:
-
-
- hidróxido de cálcio (Ca(OH)2);
- hidróxido de bário (Ba(OH)2);
- hidróxido de estrôncio (Sr(OH)2).
-
As bases formadas pelos elementos berílio e magnésio são consideravelmente pouco solúveis.
- Bases praticamente insolúveis: apresentam baixíssima solubilidade em água. Fazem parte desse grupo as bases formadas por outros elementos que não pertençam ao grupo 1 e 2 da Tabela Periódica.
- Algumas bases praticamente insolúveis são:
-
-
- hidróxido de ferro (Fe(OH)2);
- hidróxido de alumínio (Al(OH)3).
-
Solubilidade e dissociação são propriedades relacionadas. Para que uma base sofra dissociação (liberação de íons OH-), necessariamente ela precisa ser capaz de se solubilizar em água.
Leia também: Classificação dos ácidos com relação à sua força
Nomenclatura das bases
As bases são nomeadas com o termo hidróxido, que se refere à hidroxila, acompanhado do nome do cátion, da seguinte forma:

Note a nomenclatura em alguns compostos já citados no texto:
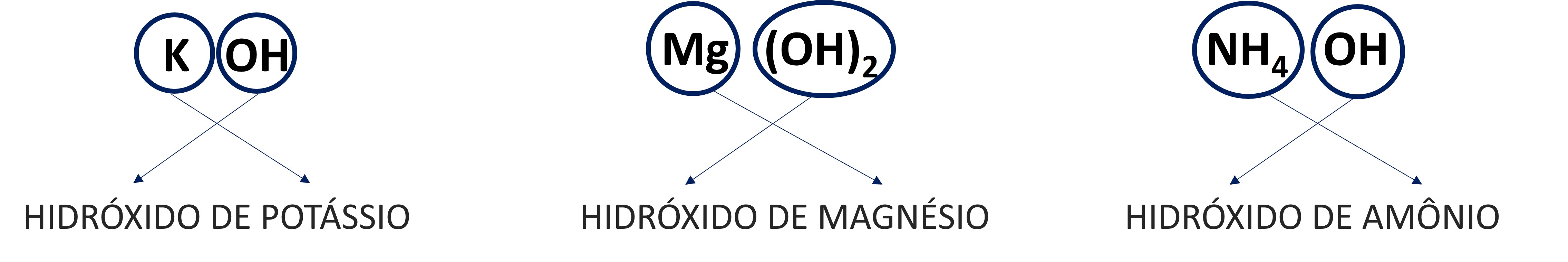
Quando o metal apresentar carga variável, seu valor é informado na forma de algarismos romanos entre parênteses, ao lado no nome do metal.
Há outra forma, mais antiga e menos utilizada, que é a adição de sufixos ao nome da base. Nesse caso, é empregado o sufixo -oso, quando o metal estiver na sua menor carga, e o sufico -ico, para a maior carga. Veja:

Principais bases
-
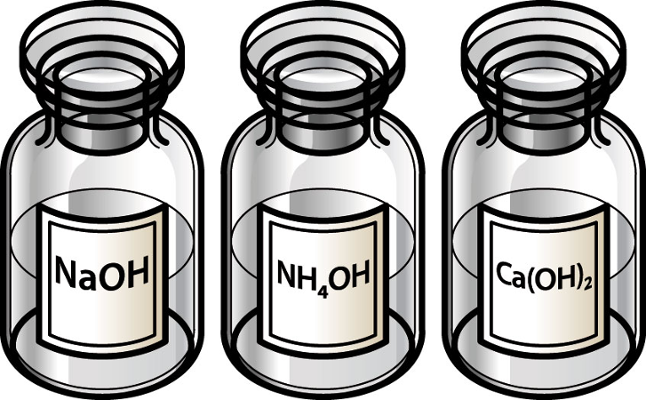
Hidróxido de sódio – NaOH
Conhecido popularmente como soda cáustica, o NaOH é uma base forte e muito corrosiva, não devendo entrar em contato com a pele. É altamente reativo com água.
É usado em diversos processos industriais, como na fabricação de papel, tecido e biodiesel. Em ambiente doméstico, essa base é utilizada em para desobstrução de encanamentos por ser capaz de “dissolver” gorduras.
O NaOH é obtido por eletrólise de solução aquosa de cloreto de sódio, o sal de cozinha.

-
Hidróxido de potássio – KOH
O KOH é uma base forte que reage com água, liberando grande quantidade de calor. Possui alto poder corrosivo, sendo perigoso no contato com pele e mucosas.
O KOH, também chamado de potassa cáustica, é muito empregado em laboratórios químicos, com diversas funções. Na indústria, participa da fabricação de sabões e detergentes, pode atuar como eletrólito de baterias alcalinas, faz parte da produção de fosfato de potássio, um reagente presente na fabricação de fertilizantes, entre outros usos.
Uma das formas mais comuns de preparar essa base é pela eletrólise ígnea do cloreto de potássio (KCl).
-
Hidróxido de magnésio – Mg(OH)2
O Mg(OH)2 é uma base fraca, e sua aplicação mais conhecida é na composição do leite de magnésia, que se trata de uma dispersão dessa base em água (pois possui baixa solubilidade). O leite de magnésia é usado como laxante.
O Mg(OH)2 é altamente alcalino, e, por não ser agressivo à pele, pode ser usado como desodorante, evitando a proliferação de microrganismos que causam mau cheiro. Entre as aplicações dessa base, estão a produção de papel e celulose, de açúcar refinado, e de agente retardante em espumas. Pode ser usado em estações de tratamento de efluentes na etapa de floculação.
O mineral brucita (MgSO4) é fonte natural de Mg(OH)2, sendo este obtido pela reação entre a brucita e hidróxido de sódio.

-
Hidróxido de cálcio – Ca(OH)2
O Ca(OH)2 possui diferentes nomes comuns, como cal extinta, cal hidratada e leite de cal. A solução aquosa de Ca(OH)2 é uma base considerada forte e pode causar queimaduras na pele. Reage com facilidade com o dióxido de carbono (CO2), formando carbonato de cálcio.
Essa base possui uma infinidade de usos, estando presente em estações de tratamento de água e efluentes, na correção do pH de solos, no tratamento de couros, na construção civil, no refino do petróleo, na fabricação de produtos químicos, na indústria alimentícia, em fármacos, na indústria cosmética e em muitos outros processos.
O Ca(OH)2 é obtido pela reação de hidratação do óxido de cálcio (CaO).

-
Hidróxido de amônio – NH4OH
O NH4OH é uma base fraca obtida pelo borbulhamento de amônia (NH3) em água, por isso só existe em solução aquosa. É muito reativo com ácidos, podendo gerar explosões.
É uma substância perigosa se ingerida, inalada ou em contato com a pele e altamente irritante aos olhos e mucosas. Mesmo assim, essa base é usada, em determinadas condições, na descoloração de cabelos. É também conhecida como amoníaco.
O NH4OH é usado na fabricação de fertilizantes como fonte de amônia. Também possui usos em tintas capilares, explosivos, lubrificantes, fabricação de óleos e gorduras, revelação de fotos e até em mecanismos de refrigeração. Uma importante função dele é na fabricação do ácido nítrico, importante reagente químico.
Usos das bases no cotidiano
As bases fazem parte do cotidiano, de forma direta e indireta, quando participam do processo de produção de algum produto que utilizamos. Veja algumas aplicações:
- O NaOH faz parte de produtos de limpeza e do processo de produção do papel.
- O KOH é o líquido interno de baterias níquel-cádmio, dióxido de manganês-zinco e níquel ferro, que são pilhas usadas em relógios e controles remotos, por exemplo.
- O Mg(OH)2 é o princípio ativo do leite de magnésia e está presente em antiácidos estomacais.
- O Ca(OH)2 é conhecido como cal, usada em construções e reguladora da acidez de solos.
- Os sabões são substâncias básicas, possuem valores de pH em torno de 10.
- Algumas frutas, como a banana e o caju, são consideradas básicas, principalmente quando ainda não estão maduras.
Leia também: Óxidos — uma das quatro principais funções inorgânicas
Exercícios resolvidos sobre bases
Questão 1
(Uece) Uma das formas de combater a azia, devido ao excesso de produção de ácido clorídrico pelo organismo, é usar o leite de magnésia, que possui caráter básico e é um antiácido estomacal. O leite de magnésia reage com o ácido clorídrico, existente no estômago, formando um sal, neutralizando, assim, o excesso de ácido que provoca a acidez (azia) estomacal. Assinale a afirmação verdadeira.
a) O leite de magnésia possui em sua composição o Mg(OH)2.
b) A fórmula química do sal formado nessa reação é Mg(OH)Cl.
c) O leite de magnésia apresenta pH menor do que 7.
d) A equação química correta dessa reação é Mg(OH)3 + 3 HCl → MgCl3 + 3 H2O.
Resolução: Letra A. Para responder a essa questão, apenas é necessário reconhecer que o leite de magnésia é composto por hidróxido de magnésio, cuja fórmula é Mg(OH)2. Portanto, item A está correto.
O sal formado na reação de neutralização proposta é o MgCl2, item B incorreto.
Como o leite de magnésia é formado por uma base, seu pH é básico, representado por um valor acima de 7. Item C incorreto.
Item D incorreto, pois a fórmula do hidróxido de manganês é Mg(OH)2.
Questão 2
(Mackenzie-SP) O suco gástrico necessário à digestão contém ácido clorídrico, que, em excesso, pode provocar “dor de estômago”. Neutraliza-se esse ácido, sem risco, ingerindo-se:
a) solução aquosa de base forte, NaOH.
b) solução aquosa de cloreto de sódio, NaCl.
c) suspensão de base fraca, Al(OH)3.
d) somente água.
e) solução concentrada de ácido clorídrico, HCl.
Resolução: Letra C. A questão trata de uma reação de neutralização, que é uma reação entre um ácido e uma base. Como o enunciado já apresenta o ácido, dentre as alternativas, deve-se escolher uma base. Sabendo que as bases são formadas por íon hidroxila (-OH‑), só seria possível utilizar o NaOH ou o Al(OH)3. Contudo, como se trata de uma base que deve ser ingerida, apenas é possível usar, com segurança, o Al(OH)3, uma base fraca. O NaOH é uma base forte e pode causar severas queimaduras, pois é corrosivo.
Créditos da imagem:
[1] Keith Homan / Shutterstock