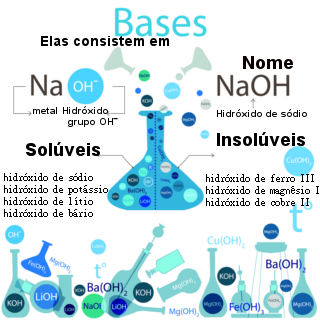
As bases, segundo a teoria da dissociação eletrolítica de Arrhenius, são compostos que se dissociam em água, liberando íons, mesmo em pequena porcentagem, dos quais o único ânion é o hidróxido, OH-.
Por exemplo: NaOH → Na+ + OH-
Saber disso é importante porque a dissociação iônica está intimamente ligada à força das bases. Quanto maior for o grau de dissociação de uma base, maior será a sua força.
O conceito de grau de dissociação das bases é análogo ao grau de ionização dos ácidos, definido por:
“O grau de dissociação (α) é a porcentagem de fórmulas unitárias da base dissolvida em água que efetivamente sofreram dissociação iônica.”
Seu cálculo é feito pela relação:
α = número de fórmulas unitárias que se dissociaram
número total de fórmulas unitárias dissolvidas no início
Se esse valor der próximo a 100%, então teremos uma base forte. Por outro lado, se esse valor der menor ou igual a 5%, teremos uma base fraca.
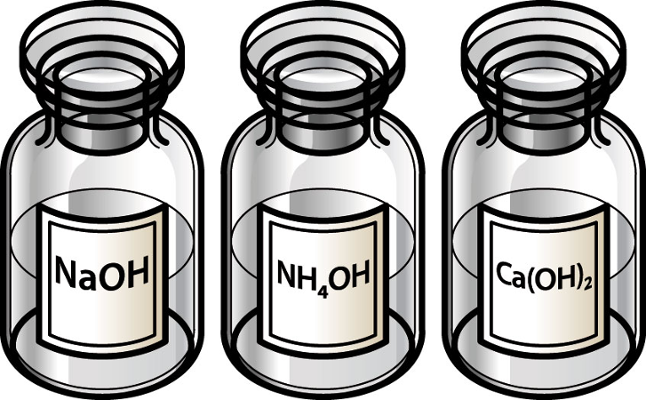
O grau de dissociação do hidróxido de sódio (NaOH), por exemplo, a 18ºC, é igual a 95%, o que mostra que essa base é forte. Essa constatação realmente é verdadeira porque esse composto é o constituinte da soda cáustica, que é usada para limpezas pesadas. Ela recebe esse nome porque é corrosiva, sendo muito perigosa para os tecidos animais. Quando uma pessoa utiliza esse produto para qualquer finalidade, é imprescindível o uso de luvas, pois o seu contato com a pele causa severas queimaduras.
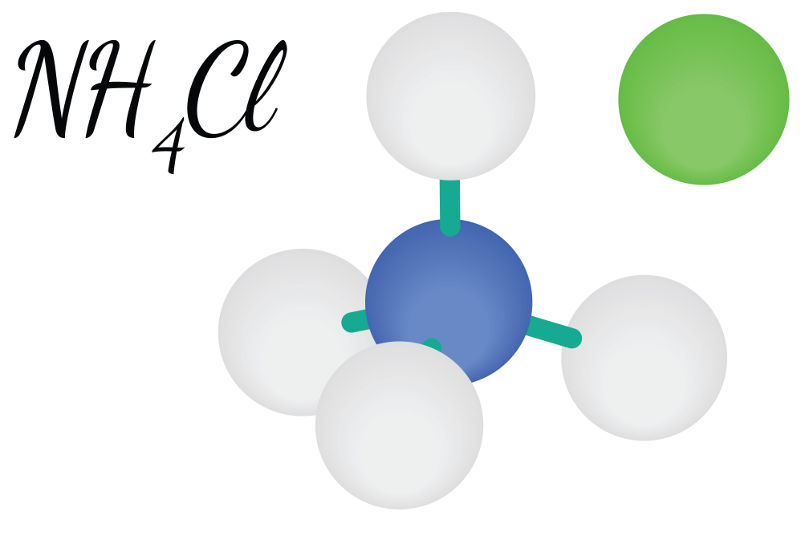
O grau de dissociação do hidróxido de amônio (NH4OH), a 18ºC, é igual a 1,5%, o que indica que se trata de uma base fraca. Essa base, inclusive, é muito instável e sofre decomposição mesmo em condições ambientes, originando água e gás amônia (NH3). Alguns autores até mesmo questionam a existência do hidróxido de amônio, pois acreditam que ele é, na verdade, uma solução de gás amônia dissolvido em água.
Determinando experimentalmente o grau de dissociação das bases, podemos afirmar o seguinte:
* Bases fortes: Bases dos metais alcalinos (LiOH, NaOH, KOH, RbOH, CsOH) e de alguns metais alcalinoterrosos (Ca(OH)2, Sr(OH)2, Ba(OH)2). O Mg(OH)2 é uma exceção, sendo uma base fraca.
* Bases fracas: O hidróxido de amônio (NH4OH) e as bases dos demais metais (das famílias 13, 14 e 15).
Por Jennifer Fogaça
Graduada em Química
Videoaula relacionada: