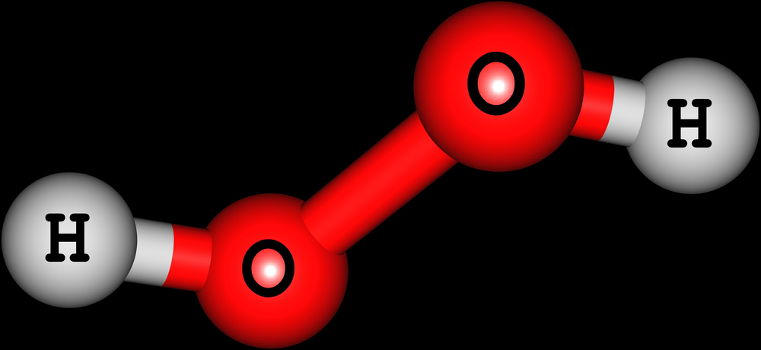
Os peróxidos são uma classe dos óxidos composta por substâncias binárias, isto é, formadas por dois elementos químicos diferentes. Um desses elementos que compõem os peróxidos é obrigatoriamente o oxigênio.
O elemento químico que acompanha o oxigênio na composição do peróxido é de natureza metálica (com exceção do peróxido de hidrogênio) e deve ser um dos relacionados a seguir:
-
Metais alcalinos (família IA)
-
Metais alcalinoterrosos (família IIA)
-
Zinco (Zn)
-
Prata (Ag)
A principal característica que um peróxido apresenta é o fato de o oxigênio possuir sempre NOX -1, independentemente do elemento que está acompanhando.
Características dos peróxidos
-
Apresentam natureza iônica (formados por ligação iônica), com exceção do peróxido de hidrogênio;
-
Com exceção do peróxido de hidrogênio, que é líquido em temperatura ambiente, todos os outros peróxidos são sólidos nessa temperatura;
-
Por causa da natureza iônica, apresentam característica básica quando participam de uma reação química;
-
São compostos relativamente instáveis, podendo sofrer decomposição e formar o gás oxigênio.
Nomenclatura dos peróxidos
A regra de nomenclatura utilizada para nomear um peróxido é:
Peróxido + de + nome do elemento que acompanha o oxigênio
Veja alguns exemplos de aplicação da regra de nomenclatura dos peróxidos:
Exemplo 1: ZnO2
Como esse peróxido apresenta o elemento zinco em sua composição, seu nome é peróxido de zinco.
Exemplo 2: BaO2
Como esse peróxido apresenta o elemento bário em sua composição, seu nome é peróxido de bário.
Exemplo 3: K2O2
Como esse peróxido apresenta o elemento potássio em sua composição, seu nome é peróxido de potássio.
Reações químicas envolvendo os peróxidos
Os peróxidos, com exceção do peróxido de hidrogênio, por apresentarem caráter básico, podem reagir com água e ácidos.
a) Reações de peróxidos com água
Quando um peróxido reage com a água, temos a formação de uma base inorgânica e o peróxido de hidrogênio (H2O2), como podemos observar nos exemplos a seguir:
Exemplo 1: Reação entre peróxido de sódio (Na2O2) e água
OBS.: O peróxido de sódio é utilizado para a descoloração de alguns tipos de papéis, deixando o produto branco.

Papéis que foram tratados com peróxido de sódio para branqueamento
K2O2 + 2 H2O → 2 KOH + H2O2
Nessa reação, temos a formação do cloreto de sódio (formado a partir do cátion do peróxido e do ânion do ácido) e peróxido de hidrogênio.
Como o peróxido de hidrogênio está em um meio básico, sofre decomposição, transformando-se em água e gás oxigênio.
H2O2 → ½ O2 + H2O
OBS.: Como temos duas moléculas de água no reagente da primeira equação e uma no produto da segunda equação, a molécula do produto anulará uma do reagente.
A reação química do peróxido de potássio na água pode ser escrita da seguinte forma:
K2O2 + 1H2O → 2 KOH + ½ O2
b) Reações de peróxidos com ácidos inorgânicos
Quando um peróxido reage com um ácido, temos a formação de um sal e o peróxido de hidrogênio (H2O2), como podemos observar nos exemplos a seguir:
Exemplo 1: Reação entre peróxido de sódio (Na2O2) e o ácido clorídrico (HCl)
Na2O2 + 2 HCl → 2 NaCl + H2O2
Nessa reação, temos a formação do cloreto de sódio (formado a partir do cátion do peróxido e do ânion do ácido) e peróxido de hidrogênio.
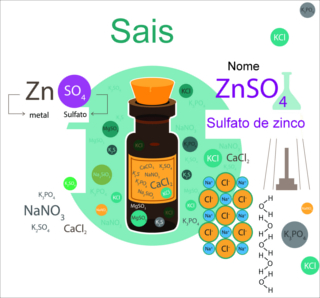
Exemplo 2: Reação entre peróxido de sódio (ZnO2) e o ácido clorídrico (H2SO4)
ZnO2 + H2SO4 → ZnSO4 + H2O2
Nessa reação, temos a formação do cloreto de sódio (formado a partir do cátion do peróxido e do ânion do ácido) e peróxido de hidrogênio.
Por Me. Diogo Lopes Dias
Videoaula relacionada: