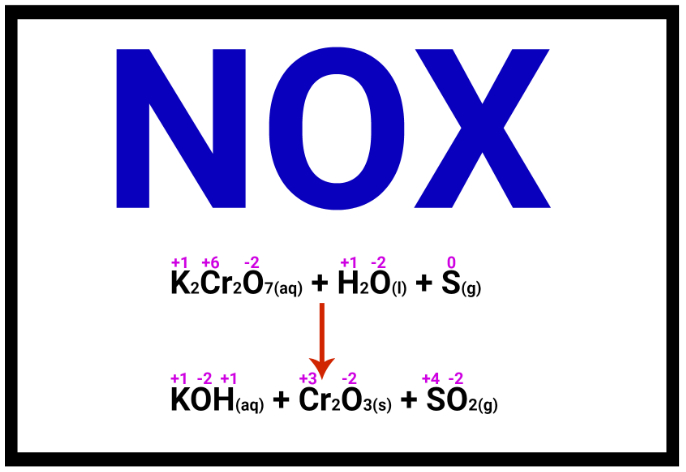
O experimento denominado de camaleão químico aborda um assunto muito importante dentro da Química, que é a alteração do número de oxidação (NOX) em decorrência de uma oxidação ou redução. Nesses fenômenos, temos espécies que recebem elétrons e outras que perdem elétrons.
No experimento, a ocorrência das reações pode ser verificada visualmente em virtude das mudanças de coloração (por isso o experimento é conhecido como camaleão químico) que ocorrem durante sua execução. Essas mudanças acontecem de forma rápida, o que exige muita atenção ao longo do procedimento.
Os materiais necessários para o experimento são:
-
Luvas descartáveis
-
Jaleco
-
1 Béquer de 1000 mL ou outro recipiente transparente de igual volume
-
2 Béqueres de 250 mL ou outros recipientes transparentes de igual volume
-
2 Baquetas ou colheres grandes convencionais
-
Colheres descartáveis
-
Água
-
Cartela de comprimidos ou de flaconetes (cartelas que já vêm com o material em pó) contendo permanganato de potássio.
OBS.: Caso opte por utilizar o permanganato em comprimido, é necessário pulverizá-lo ou transformá-lo em pó utilizando um cadinho e um pistilo.
-
Hidróxido de sódio ou soda cáustica (cerca de 80 gramas)
-
Açúcar (cerca de 40 gramas)
-
Pincel atômico
OBS: A execução do experimento deve ser feita com cautela para evitar que a soda cáustica entre em contato com alguma região do corpo.
Procedimento experimental
a) Preparo da solução 1
Escrever solução 1 na lateral de um dos béqueres de 250 mL e logo após:
1º) Adicionar um flaconete ou um comprimido pulverizado;
2º) Adicionar 150 mL de água;
3º) Misturar bem com o auxílio de uma baqueta até que a mistura fique homogênea.
A solução preparada terá uma coloração violeta.
b) Preparo da solução 2
Escrever solução 2 na lateral do outro béquer de 250 mL e logo após:
1º) Adicionar 150 mL de água;
2º) Adicionar em seguida uma colher (a descartável) de hidróxido de sódio;
3º) Mexer muito bem com o auxílio da baqueta até que a mistura se torne homogênea;
4º) Após homogeneizar, adicionar duas colheres (também descartáveis) de açúcar à mistura de água e hidróxido de sódio;
5º) Mexer, novamente, muito bem com o auxílio da baqueta até que mistura se torne homogênea.
A solução preparada será incolor.
c) Preparo da solução 3
A solução 3 é simplesmente a mistura das duas soluções anteriores no interior do béquer de 1000 mL. Assim, escreva solução 3 na lateral do béquer e proceda da seguinte forma:
1º) Adicione toda a solução 1 no interior do béquer 3;
2º) Com o auxílio da baqueta, mexa o líquido no interior do béquer, fazendo círculos de forma bem rápida;
3º) Imediatamente após o procedimento anterior, adicione toda a solução 2 no interior do béquer 3;
4º) Agora é só observar as mudanças de cor.
-
Compreendendo o experimento
Quando colocamos a solução 1 em contato com a solução 2, a cor violeta mudará para uma coloração esverdeada, que, com o tempo, tornar-se-á marrom (ou castanho). Pode acontecer ainda de aparecer uma coloração avermelhada, mas isso depende muito das quantidades de líquidos e sólidos utilizados.
Resumindo: teremos ao longo do experimento a presença de até quatro cores diferentes. Agora, por que isso acontece?
Quando adicionamos o permanganato de potássio (KMnO4) na água (aq), há a dissolução e, consequentemente, dissociação do sal em água, liberando íons permanganato (MnO4-) no meio:
KMnO4(aq) → K+ + MnO4-
OBS.: O permanganato (MnO4-) apresenta o Manganês (Mn) com um NOX igual a +7.
Com o hidróxido de sódio (NaOH), também ocorre uma dissociação e consequente liberação de íons sódio (Na+) e hidróxido (OH-):
NaOH(aq) → Na+ + OH-
Como o açúcar (C12H22O11) é molecular, ao se dissolver, não sofre dissociação. Porém, a presença dos íons provenientes do hidróxido de sódio faz com que ele libere elétrons para o meio.
C12H22O11(aq) → elétrons
Ao misturarmos a solução 1 com a 2, os íons permanganato encontram um ambiente cheio de elétrons. Assim, cada um recebe um elétron e transforma-se em íons manganato (MnO4-2), que possui coloração esverdeada.
MnO4- + elétron → MnO4-2
OBS.: O manganato (MnO4-2) apresenta o Manganês (Mn) com um NOX igual a +6.
O íon manganato em meio diluído transforma-se em dióxido de manganês (MnO2), que apresenta coloração marrom:
MnO4-2(aq) → MnO2
OBS.: No dióxido de Manganês, o manganês apresenta um NOX igual a 4.
Alguns cátions Manganês podem interagir com o açúcar restante no meio reacional, formando um cátion manganês com NOX +3, o que favorece o aparecimento da cor avermelhada.
Observa-se, então, ao final, que houve redução do NOX do Manganês ao longo de todo o experimento.
Por Me. Diogo Lopes Dias