A eletrólise em meio aquoso é um processo não espontâneo que utiliza uma corrente elétrica para induzir as reações de oxidação e redução de íons que estão dissolvidos em água.
Para a realização da eletrólise em meio aquoso, uma substância iônica, como um sal inorgânico, deve ser dissolvida em água para que uma corrente elétrica seja descarregada sobre esses materiais.
Componentes de uma eletrólise em meio aquoso
.jpg)
Os componentes básicos de uma eletrólise em meio aquoso são:
-
Dois eletrodos inertes (não sofrem nenhuma reação). Um deve ser ligado ao cátodo da bateria, e o outro, ao ânodo;
-
Cuba;
-
Uma solução com água e um soluto iônico;
-
Uma fonte de corrente contínua (bateria).
O que ocorre em uma eletrólise em meio aquoso?
-
Dissolução do soluto iônico em água
Quando um soluto iônico, como um sal, é dissolvido em água, ele sofre dissociação, ou seja, libera um cátion e um ânion. Veja a equação que representa a dissociação do cloreto de sódio em água:
NaCl(aq) → Na+(aq) + Cl-(aq)
O cloreto de sódio libera o cátion sódio (Na+) e o ânion cloreto (Cl-).
-
Autoionização da água
A água é uma substância que por si só sofre o fenômeno da autoionização, no qual produz um cátion hidrônio (H+) e o ânion hidróxido (OH-), como podemos observar na equação a seguir:
H2O(L) → H+(aq) + OH-(aq)
Com isso, há dois cátions e dois ânions na solução.
-
Íons que são influenciados pela descarga elétrica
Com a dissolução do soluto e a autoionização da água, o meio eletrolítico passa a ter os cátions hidrônio e sódio e os ânions cloreto e hidróxido. Todavia, apenas um cátion e um ânion são influenciados pela descarga.
Para saber qual íon é influenciado pela descarga, basta seguir a ordem decrescente de descarga para cátions e ânions proposta a seguir:
-
Para os cátions:
Qualquer outro metal > H+ > metais das famílias IA, IIA ou IIIA
-
Para os ânions:
Ânions sem oxigênio > OH- > F- ou qualquer ânion com oxigênio
-
Descarga do cátion
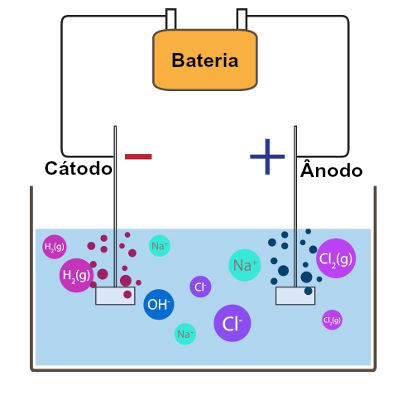
Quando a fonte de corrente elétrica é ligada, os elétrons chegam até o cátodo (polo negativo), e os cátions presentes na solução dirigem-se até o cátodo para receber esses elétrons, formando um metal estável, como descrito na equação a seguir:
Y+(aq) + e → Y(s)
No caso da eletrólise do cloreto de sódio, os cátions presentes na solução são o hidrônio e o sódio (família IA). Como o hidrônio tem prioridade de descarga, ele receberá os elétrons, ou seja, sofrerá redução, como mostra a equação a seguir:
2H+ + 2e → H2(g)
OBS.: A equação deve ser balanceada porque, para originar o H2, são necessários dois hidrônios e dois elétrons.
-
Descarga do ânion
Durante a eletrólise, enquanto os cátions sofrem redução, os ânions sofrem oxidação (perda de elétrons) no ânodo, favorecendo o trânsito de elétrons no circuito da eletrólise. Como resultado, o ânion sempre forma substância simples.
No caso da eletrólise em meio aquoso do cloreto de sódio, o ânion que tem prioridade de descarga é o cloro, já que ele é um ânion não oxigenado. Ele se transforma na substância simples gás cloro, como na equação a seguir:
2Cl-(aq) → 2e + Cl2(g)
OBS.: para formar o gás cloro, são necessários dois ânions cloreto, o que libera, consequentemente, dois elétrons.
Equações em uma eletrólise em meio aquoso
Em uma eletrólise em meio aquoso, sempre teremos quatro equações:
-
Dissociação;
-
Autoionização da água;
-
Redução do cátion;
-
Oxidação do ânion.
A soma de todas essas equações gera uma equação global, a qual representa a eletrólise. No caso da eletrólise em meio aquoso do cloreto de sódio, temos as seguintes equações:
-
Dissociação do sal: 2NaCl(aq) → 2Na+(aq) + 2Cl-(aq)
Como na equação de oxidação do ânion o cloro foi duplicado, essa equação também deve ser duplicada.
-
Autoionização da água: 2H2O(L) → 2H+(aq) + 2OH-(aq)
Como na equação de redução do cátion o hidrônio foi duplicado, essa equação também deve ser duplicada.
-
Redução do cátion: 2H+(aq) + 2e → H2(g)
-
Oxidação do ânion: 2Cl-(aq) → 2e + Cl2(g)
Eliminando os itens que se repetem no produto de uma equação com os reagentes de outra equação, formamos a equação geral dessa eletrólise.
-
Equação geral: 2NaCl(aq) + 2H2O(L) → 2Na+(aq) + 2OH-(aq) + H2(g) + Cl2(g)
Como na equação global temos a presença de ânion hidróxido (OH-) e cátions sódio (Na+), na eletrólise em meio aquoso do cloreto de sódio, além da produção dos gases cloro e hidrogênio, temos também a produção de hidróxido de sódio.
Por Me. Diogo Lopes Dias