Hidrólise de sais é um equilíbrio químico que ocorre após a adição de um sal (YX) à água. Esse processo acontece por causa da ionização da água, a qual produz o cátion hidrônio (H+) e o ânion hidróxido (OH-), e da dissociação do sal, que libera um cátion qualquer (Y+) e um ânion qualquer (X-).
Em resumo, a hidrólise dos sais é a interação entre os íons do sal com os íons da água, isto é, o cátion de um com o ânion do outro, o que pode resultar nas seguintes substâncias:
-
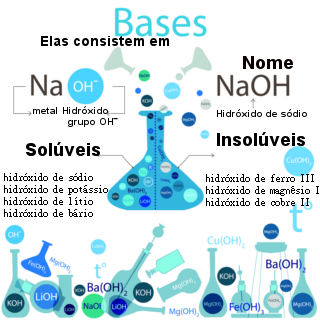
Cátion do sal (Y+) com o ânion da água (OH-) = base inorgânica (YOH)
-
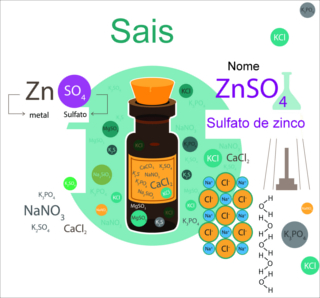
Cátion da água (H+) com o ânion do sal (X-) = ácido inorgânico (HX)
Porém, a interação entre os íons não ocorre quando a base ou o ácido formados são fortes, uma vez que essas substâncias fortes apresentam um elevado grau de dissociação, ou seja, uma tendência a permanecer na forma de íons.
Assim, quando misturamos um sal à água, podemos obter ou não a formação de ácido ou base (hidrólise), ou de ambos. Isso pode influenciar diretamente no pH do meio da seguinte forma:
-
Formação de ácido e base: não haverá a presença de íons hidrônio e hidróxido na solução, o que tornará o meio neutro (com pH = 7);
-
Formação apenas da base: existirá a presença de íons hidrônio na solução, o que tornará o meio ácido (com pH < 7);
-
Formação apenas do ácido: haverá a presença de íons hidróxido na solução, o que tornará o meio básico (com pH > 7);
-
Não existirá formação de ácido nem de base: haverá os íons hidróxido e hidrônio na solução, o que tornará o meio neutro (com pH = 7).
Hidrólise de sais com formação de meio neutro
A hidrólise de sais com a formação de um meio neutro ocorre em duas situações:
1ª- Quando o sal apresenta cátion capaz de formar base forte e ânion capaz de formar ácido forte;
Para facilitar o entendimento, vamos utilizar o exemplo da hidrólise do iodeto de potássio (KI).
-
Íons no iodeto de potássio:
O iodeto de potássio apresenta o cátion potássio (K+1) e o ânion iodeto (I-1).
-
Relação entre o cátion do sal e o ânion hidróxido (OH-) da água:
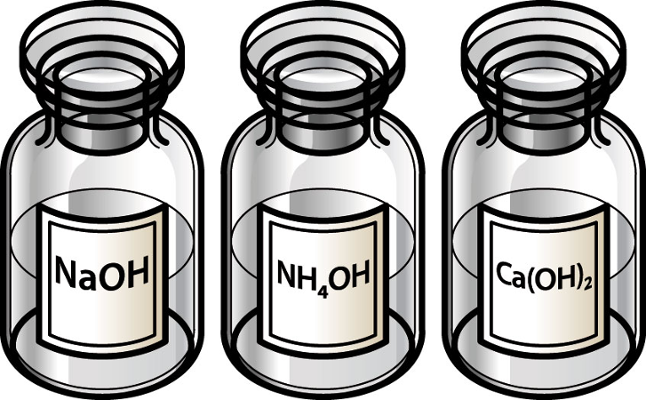
Como o potássio pertence à família IA, seu cátion não sofre hidrólise, ou seja, não interage com o hidróxido, resultando na base forte hidróxido de potássio [KOH]. Dessa forma, restarão íons hidróxido na solução.
-
Relação entre o ânion do sal e o cátion hidrônio (H+) da água:
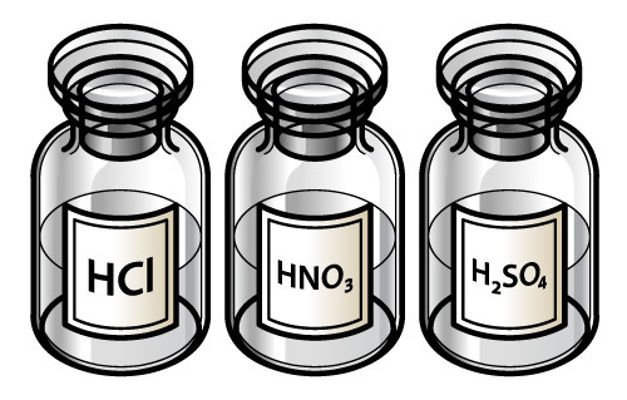
Se o ânion iodeto (I-1) interagisse com o hidrônio (H+), haveria a formação do hidrácido ácido iodídrico (HI), que é um dos três hidrácidos considerados fortes (além do HCl e do HBr). Dessa forma, o iodeto não sofre hidrólise, restando cátions hidrônio na solução. Após a adição do iodeto de potássio, como existirão cátions hidrônio e ânions hidróxido, a solução será neutra.
2ª- Quando o sal apresenta cátion capaz de formar base fraca e ânion capaz de formar ácido fraco.
Para facilitar o entendimento, vamos utilizar o exemplo da hidrólise do sulfeto de magnésio (MgS).
-
Íons no sulfeto de magnésio:
Não pare agora... Tem mais depois da publicidade ;)
O sulfeto de magnésio apresenta o cátion magnésio (Mg+2) e o ânion sulfeto (S-2).
-
Relação entre o cátion do sal e o ânion hidróxido (OH-) da água:
Mesmo com o magnésio pertencendo à família IIA, seu cátion sofre hidrólise, ou seja, interage com o hidróxido e forma a base fraca hidróxido de magnésio [Mg(OH)2].
-
Relação entre o ânion do sal e o cátion hidrônio (H+) da água:
Se o ânion sulfeto (S-2) interagisse com o hidrônio (H+), haveria a formação do hidrácido ácido sulfídrico (H2S), que é fraco, já que apenas HCl, HBr, HI são hidrácidos fortes. Dessa forma, o sulfeto sofre hidrólise, não restando cátions hidrônio na solução. Após a adição do sulfeto de magnésio à água, como não haverá cátions hidrônio e ânions hidróxido, a solução será neutra.
Hidrólise de sais com formação de meio ácido
A hidrólise de sais pode formar um meio ácido quando um sal apresenta cátion capaz de formar base fraca e ânion capaz de formar ácido forte. Para facilitar o entendimento, vamos utilizar o exemplo da hidrólise do sulfato de ferro II (FeSO4).
-
Íons no sulfato de ferro II:
O sulfato de ferro II apresenta o cátion ferro II (Fe+2) e o ânion sulfato (SO4-2).
-
Relação entre o cátion do sal e o ânion hidróxido (OH-) da água:
Como o ferro não pertence às famílias IA, IIA (com exceção do magnésio) e IIIA, seu cátion ferro II sofre hidrólise, ou seja, interage com o hidróxido e forma a base fraca hidróxido de ferro II [Fe(OH)2].
Obs.: Não há a presença de íons hidróxido na solução.
-
Relação entre o ânion do sal e o cátion hidrônio (H+) da água:
Se o ânion sulfato (SO4-2) interagisse com o hidrônio (H+), haveria a formação do oxiácido ácido sulfúrico (H2SO4). Esse ácido é considerado forte, uma vez que, para os oxiácidos, o resultado da subtração entre oxigênios e hidrogênios deve ser maior ou igual a dois. Dessa forma, restarão íons hidrônio na solução, o que faz dela uma solução ácida.
Hidrólise de sais com formação de meio básico
A hidrólise de sais com formação de um meio básico ocorre quando um sal apresenta cátion capaz de formar base forte e ânion capaz de formar ácido fraco. Para facilitar o entendimento, vamos utilizar o exemplo da hidrólise do cianeto de cálcio [Ca(CN)2].
-
Íons no cianeto de cálcio:
O cianeto de cálcio apresenta o cátion cálcio (Ca+2) e o ânion cianeto (CN-1).
-
Relação entre o ânion do sal e o cátion hidrônio (H+) da água:
Se o ânion cianeto (CN-1) interagisse com o hidrônio (H+), haveria a formação do hidrácido ácido cianídrico (HCN), que é fraco, já que apenas HCl, HBr, HI são hidrácidos fortes. Dessa forma, o cianeto sofre hidrólise, não restando cátions hidrônio na solução.
-
Relação entre o cátion do sal e o ânion hidróxido (OH-) da água:
Como o cálcio pertence à família IIA, seu cátion não sofre hidrólise, ou seja, não interage com o hidróxido, pois resulta na base forte hidróxido de cálcio [Ca(OH)2]. Dessa forma, restarão íons hidróxido na solução, o que faz dela uma solução básica.
Por Me. Diogo Lopes Dias
Videoaula relacionada: