Quando a concentração de uma solução (principalmente líquidas e gasosas) é dada em valores extremamente pequenos, costuma-se utilizar a unidade parte por milhão (ppm).
A concentração de soluções químicas refere-se à quantidade de soluto que existe em uma quantidade padrão de solução ou em uma quantidade padrão de solvente. Assim, a concentração em partes por milhão pode ser definida da seguinte maneira:
* Partes por milhão (ppm): Indica quantas partes de soluto (em massa ou em volume) existem em um milhão (1 000 000 ou 106) de partes da solução (também em massa ou em volume).
Isso significa que podemos descobrir o ppm pela seguinte expressão matemática:
x ppm = __x parte do soluto__
106 partes de solvente (solução)
Visto que a quantidade de soluto é extremamente pequena, nos cálculos que utilizam a fórmula acima, o volume ou a massa da solução serão considerados exatamente os mesmos do solvente, ou seja, se soubermos que uma solução aquosa de permanganato de potássio (KmnO4(aq)) tem concentração de 70 ppm, isso significa que existem 70 g de permanganato em 1 milhão de gramas da solução ou de água, conforme mostra a fórmula:
70 ppm = _70 g do permanganato_
106 g de água
Tendo em vista que:
106 g = 1 t;
10-3 g = 1 mg;
103 g = 1 kg;
10-6 g = 1 μg.
Podemos fazer então o cálculo usando também as seguintes relações:
* 1 ppm = 1 g do soluto__
1 t de solvente (solução)
* 1 ppm = 1 mg do soluto__
1 kg de solvente (solução)
* 1 ppm = 1 μg do soluto__
1 g de solvente (solução)
Relações similares podem ser feitas com as unidades de volume:
* 1 ppm = 1 L do soluto__
1000 m3 de solvente (solução)
* 1 ppm = 1 mL do soluto__
1 m3 de solvente (solução)
* 1 ppm = 1 μL do soluto__
1 L de solvente (solução)
* 1 ppm = 1 mL do soluto__
1000 L de solvente (solução)
Também podemos relacionar massa e volume em soluções, por exemplo, que são formadas por um soluto sólido dissolvido em um solvente líquido:
* 1 ppm = 1 g do soluto__
1000 L de solvente (solução)
* 1 ppm = 1 mg do soluto__
1 L de solvente (solução)
* 1 ppm = 1 μL do soluto__
1 mL de solvente (solução)
Assim como ppm significa “partes por milhão”, ppb significa “partes por bilhão”, e ppt é “partes por trilhão”:
x ppb = __x parte do soluto__
109 partes de solvente (solução)
x ppt = __x parte do soluto__
1012 partes de solvente (solução)
Essas concentrações tão pequenas são aplicadas principalmente quando se trabalha com dados referentes à poluição do ar e da água. Veja abaixo uma tabela que mostra os principais gases-estufa presentes na atmosfera terrestre e a sua abundância (dados de 1998):
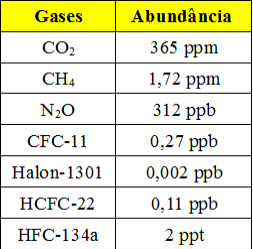
Tabela com abundância de gases-estufa na atmosfera
Esse é um exemplo que mostra que o uso desse tipo de concentração é importante tanto para estabelecer um limite máximo para esse e outros poluentes quanto para monitorá-los. Também pode ser usado em cosméticos e produtos de limpeza e higiene pessoal para mostrar a quantidade de seus constituintes.
Veja agora dois exemplos de exercícios envolvendo o cálculo da concentração de soluções em ppm e ppb:
Exemplo 1: (Fatec-SP) No rótulo de uma garrafa de água mineral lê-se, entre outras informações:
Conteúdo: 1,5 litro;
Nitrato de sódio: 6,0 ppm.
Considere que 1 ppm equivale a 1 mg de soluto por litro de solução aquosa. A massa de nitrato de sódio ingerida por uma pessoa que bebe um copo 300 mL dessa água é?
a) 0,003 g b) 0,0018 g c) 9,0 g d) 6,0 mg e) 1,2 mg
Resolução:
1 mg de nitrato de sódio (1 ppm) ------- 1 L
6 mg de nitrato de sódio (6 ppm) ------- 1000 mL
x-------------------------- 300 mL
x = 300 . 6
1000
x = 1,8 mg de nitrato de sódio
1 g ----- 1000 mg
y-------- 1,8 mg
y = 1,8 . 1
1000
y = 0,0018 g de nitrato de sódio
A alternativa correta é a letra “b”.
Exemplo 2: (Fatec-SP) Uma das formas de medir o grau de intoxicação por mercúrio em seres humanos é a determinação de sua presença nos cabelos. A Organização Mundial de Saúde (OMS) estabeleceu que o nível máximo permissível, sem risco para a saúde, é de 50 ppm, ou seja, 50. 10-6 g de mercúrio por grama de cabelo. Forneça a expressão dessa concentração em ppb.
Resolução:
1 bilhão = 109.
50 partes de mercúrio ---- 106 partes de cabelo
x------------------------------109 partes de cabelo
x = 109 . 50
106
x = 5 . 104 ppb
Por Jennifer Fogaça
Graduada em Química
Videoaula relacionada: