Título é o nome que se dá a um tipo de concentração de soluções utilizado na Química que relaciona o número de unidades de soluto (substância que se dissolve) que estão presentes em 100 unidades de volume da solução. Essa concentração é uma grandeza simbolizada pela letra grega tau (τ).
Pode-se calcular o título de uma solução por meio da seguinte fórmula:
τ = m1 ou τ = m1__
m m1 + m2
Observe que o índice “1” indica que a massa é do soluto, o índice “2” é o dado do solvente e, quando não há índice, a grandeza refere-se à solução.
Veja um exemplo: Considere uma solução formada dissolvendo-se 20 g de sal de cozinha (NaC?) em 80 g de água. Isso significa que a massa da solução é igual a 100 g ( m = m1 + m2 = 20 + 80 = 100). Assim, podemos calcular o título em massa dessa solução:
τ = m1
m
τ = 20 g
100 g
τ = 0,2
O título em massa dessa solução é igual a 0,2. Note que o título é um número puro, pois as unidades que estão relacionadas no numerador e no denominador da fórmula são as mesmas e anulam-se.
Essa relação pode ser expressa também em porcentagem. No caso acima, fica fácil encontrar essa porcentagem, pois existem 20 g de soluto em 100 g de solução, ou seja, 20/100 ou 20% em massa.
Mas, no caso de outros valores mais difíceis, basta calcular o título normalmente e depois multiplicar o valor encontrado por 100%:
τ = m1 . 100%
m
Um exemplo de porcentagem em massa muito comum no cotidiano, que talvez você nem tenha reparado ainda, é a que aparece nas embalagens de soros fisiológicos. Como a imagem abaixo mostra, a sua porcentagem em massa é igual a 0,9%, o que significa que em 100 g de soro existe 0,9 g de cloreto de sódio e o seu título é igual a 0,009.
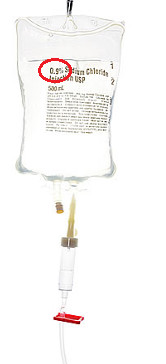
Porcentagem em massa de cloreto de sódio em soro fisiológico
Para resolver os exercícios envolvendo título e porcentagem em massa das soluções, podem ser usadas também regras de três. Veja um exemplo:
Exemplo: (FEI-SP) As massas respectivamente de H2C2O4 e H2O que devem ser misturadas para preparar 1000 g de solução 5% de H2C2O4 são:
a) 60 g e 940 g
b) 90 g e 910 g
c) 50 g e 950 g
d) 108 g e 892 g
e) 70 g e 930 g
Resolução:
Uma solução com 1000 g e com porcentagem em massa de 5% terá:
1000 g –------ 100%
m1------------- 5%
m1 = 5000
100
m1= 50 g
Visto que a solução tem 1000 g e 50 g são de H2C2O4, então a quantidade de água será de:
1000 – 50 = 950 g.
A resposta correta é a alternativa “c”.
Aproveite para conferir nossa videoaula sobre o assunto: