Os íons são espécies químicas carregadas eletricamente, sendo formados quando um átomo ou um grupo de átomos perde ou ganha elétrons na sua eletrosfera. Se o átomo ganhar elétrons, ele torna-se um ânion, ficando com carga negativa. Por outro lado, se o átomo perder elétrons, ele fica com carga positiva e é chamado de cátion.
Isso acontece porque quando o átomo está no estado fundamental, ele é eletricamente neutro, uma vez que a quantidade de prótons (cargas positivas) é exatamente igual à quantidade de elétrons (cargas negativas). Assim, quando ganha um elétron, o átomo fica com uma carga negativa a mais e, por isso, ele é representado da seguinte forma: X-1, em que “X” é o símbolo do elemento químico. Se dois elétrons foram acrescentados, ele fica com carga -2 e assim por diante.
O mesmo princípio aplica-se para os cátions, mas com carga contrária, ou seja, para cada elétron perdido, o cátion fica com uma carga positiva a mais (X1+).
Quando o átomo ganha ou perde elétrons — isso ocorre na sua camada de valência, isto é, na camada mais externa ao núcleo —, a sua configuração eletrônica é alterada.
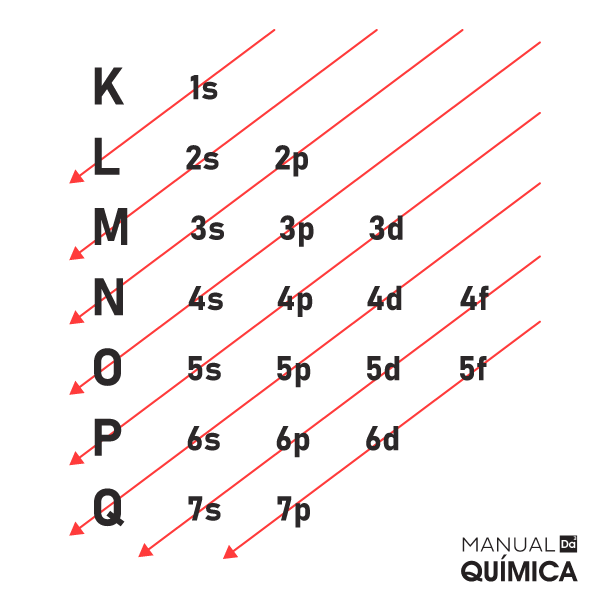
No texto “Distribuição eletrônica” foi mostrado que a configuração eletrônica de um átomo, isto é, como os elétrons estão distribuídos nas camadas eletrônicas do átomo, é identificada por meio do diagrama criado por Linus Pauling, que é o mostrado abaixo:

A representação gráfica da distribuição eletrônica é dada pelo Diagrama de Pauling
Para realizar a distribuição eletrônica no caso de íons, esse diagrama também pode ser utilizado, basta fazer o seguinte:
1º) Realize a distribuição eletrônica no diagrama de Pauling na ordem energética, isto é, seguindo a ordem dada pelas setas, para o átomo do elemento no estado fundamental;
2º) Retire ou adicione a quantidade de elétrons que o átomo perdeu ou ganhou a partir do subnível e do nível mais externo no átomo no estado fundamental.
É importante lembrar que a modificação não será no subnível mais energético, que foi o último a ser preenchido, mas sim no subnível mais externo, que é o que fica na camada mais distante do núcleo.
Vejamos um exemplo: Abaixo temos a distribuição eletrônica do cádmio no estado fundamental, sendo que seu número atômico é igual a 48:
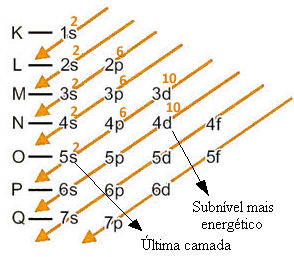
Distribuição eletrônica do cádmio no estado fundamental
Em ordem energética, essa distribuição é dada por: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10.
Ao realizar essa distribuição, nota-se que o subnível 4d10 foi o último preenchido. Porém, esse é o mais energético, e não o mais externo. O que fica mais longe do núcleo, na camada de valência, é 5s2 e é ele que será alterado na formação de algum íon.
Digamos, então, que o cádmio formou o seguinte cátion: (Cd2+). E agora? Como ficará a sua distribuição eletrônica?
Bem, a carga +2 indica que ele perdeu 2 elétrons, então basta retirar os dois elétrons no subnível 5s2.
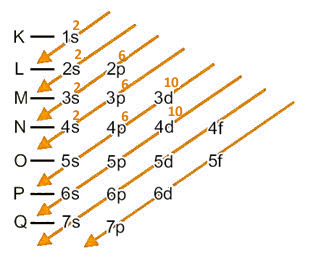
Distribuição eletrônica do cátion cádmio no diagrama de Pauling
A distribuição do íon Cd2+ em ordem energética é dada por: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10.
Se fossem mais de 2 elétrons perdidos, continuaríamos a retirada dos elétrons, indo para o subnível anterior.
Por outro lado, se fosse um ânion, iríamos acrescentar elétrons nesse subnível mais externo. Entretanto, como no subnível s não podem ser preenchidos mais de 2 elétrons, passaríamos para o próximo subnível.
Aproveite para conferir nossas videoaulas relacionadas ao assunto: