Uma característica interessante da grande maioria dos elementos químicos é a necessidade de adquirir estabilidade (obedecer à regra do octeto), já que poucos são gases nobres (apresentam oito elétrons na camada de valência) e, portanto, estáveis. Essa estabilidade é adquirida quando os átomos estabelecem entre si uma ligação química (interação entre átomos por meio dos seus elétrons e orbitais). Para entender a Regra do Octeto de forma mais detalhada, confira o texto Regra do Octeto que se detém só sobre esse assunto.
Um exemplo de ligação química é a que ocorre entre um átomo de sódio e um átomo de cloro, formando o cloreto de sódio (sal de cozinha). Nessa ligação temos o envolvimento de um átomo metálico (sódio) e um átomo ametal (cloro). A seguir temos a fórmula que representa o cloreto de sódio:
NaCl
Ao avaliar a posição de um elemento químico na tabela periódica, podemos prever o seu comportamento durante uma ligação química. Esse tipo de avaliação é possível com o auxílio das propriedades periódicas (características dos elementos que dependem do período da tabela e do número atômico). Uma dessas propriedades periódicas é a chamada eletropositividade ou caráter metálico.
Denomina-se eletropositividade ou caráter metálico a capacidade que um átomo apresenta de perder elétrons quando está ligado a outro átomo.
Essa capacidade está intimamente relacionada com três fatores importantes:
1. Raio atômico: quanto maior for o raio atômico, maior será a eletropositividade. Se o átomo é grande, a força de atração do núcleo em relação aos elétrons da periferia é pequena, o que torna a perda do elétron mais fácil.
2. Período: quanto menor for o número atômico, maior será a eletropositividade. Isso ocorre porque, se o número de elétrons no núcleo é pequeno, a força de atração tende a ser menor, facilitando a perda do elétron. Assim, nos períodos da Tabela Periódica, a eletropositividade cresce da direita para a esquerda.

O aumento da eletropositividade em um período da Tabela Periódica acontece da direita para a esquerda
3. Família: quanto maior for o número atômico e o número de níveis, maior será a eletropositividade. Nas famílias da Tabela Periódica, os elementos localizados abaixo uns dos outros apresentam maior número atômico e maior número de níveis em seus átomos, o que favorece uma menor força de atração do núcleo em relação aos elétrons da periferia. Assim, nas famílias da tabela periódica, a eletropositividade cresce de cima para baixo.
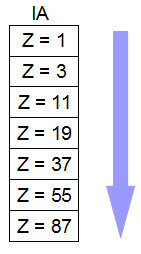
Aumento da eletropositividade em uma família da Tabela Periódica
Com esses conhecimentos, ao avaliar o exemplo do NaCl, temos a certeza de que nessa molécula quem perde elétrons na ligação química é o sódio, pois este apresenta maior eletropositividade que o cloro.
Veja um esquema geral da eletropositividade:
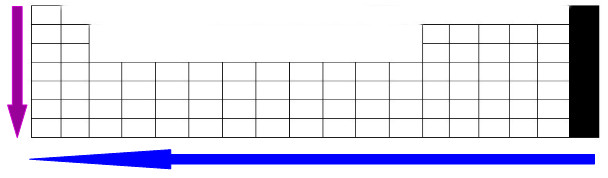
Esquema que representa o aumento da eletropositividade nos períodos e famílias da Tabela Periódica
Por Me. Diogo Lopes Dias
Videoaula relacionada: