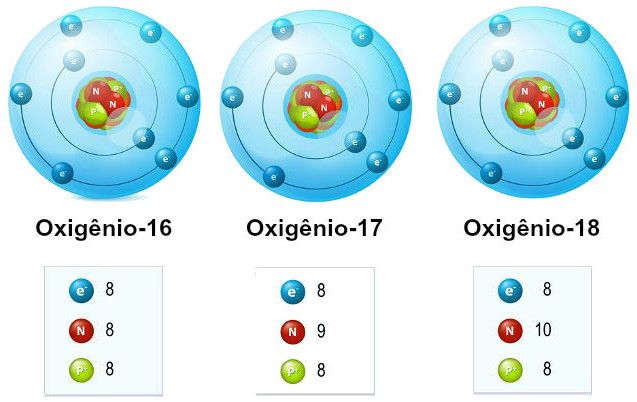
No texto “Isótopos”, você viu que estes são átomos que pertencem ao mesmo elemento químico e que, por isso, possuem o mesmo número de prótons (ou número atômico (Z)), mas apresentam diferente número de nêutrons e, consequentemente, diferente número de massa (A).
Agora falaremos de outros casos de semelhanças atômicas, que ocorrem, porém, entre átomos de elementos químicos diferentes:
* Isótonos: Átomos que possuem o mesmo número de nêutrons, mas diferentes números atômicos (Z) e de massa (A).
Por exemplo, observe as representações dos quatro elementos químicos a seguir:
1737Cl 2040Ca 1226Mg 1428Si
Conforme explicado no texto Cálculo das Partículas Atômicas, os números subscritos (na parte inferior) representam o número atômico (Z), que se refere aos prótons. Já os números sobrescritos (na parte superior) correspondem ao número de massa (A). Visto que o número de massa é a soma dos prótons com os nêutrons existentes no núcleo, é possível, por meio dos valores fornecidos, descobrir quantos nêutrons cada um desses átomos possui:
A = P + N
N = A – P
Veja:
| 1737Cl N = A – P N = 37-17 N = 20 |
2040Ca N = A – P N = 40 - 20 N = 20 |
1226Mg N = A – P N = 26 - 12 N = 14 |
1428Si N = A – P N = 28 - 14 N = 14 |
Veja que o 1737Cl e o 2040Ca possuem 20 nêutrons, sendo, portanto, isótonos um do outro. Já o 1226Mg e o 1428Si possuem 14 nêutrons e são isótonos entre si.
Observe que ambos os pares de isótonos possuem os números atômicos e os números de massa diferentes, o que resulta em diferentes propriedades químicas e físicas.
* Isóbaros: Átomos que possuem o mesmo número de massa (A), mas diferentes números atômicos (Z).
Os exemplos a seguir são isóbaros, pois todos possuem o número de massa igual a 40: 2040Ca, 1940K, 1840Ar.
* Isoeletrônicos: Átomos ou íons que possuem o mesmo número de elétrons.
Para determinar a quantidade de elétrons, é necessário verificar se se trata de um átomo no estado fundamental ou um íon. Se for um átomo no estado fundamental, a quantidade de elétrons será exatamente igual à quantidade de prótons, pois, nessa condição, a carga total do átomo é nula. Por outro lado, no caso dos íons, a quantidade de elétrons será indicada pela sua carga. Se a carga é positiva (cátion), quer dizer que o átomo perdeu elétrons; mas se é negativa (ânion), significa que o átomo ganhou elétrons.
Por exemplo, note os casos a seguir:
1020Ne 1123Na+ 816O2-
O neônio está no estado fundamental e não possui carga, logo, a sua quantidade de elétrons é igual ao número de prótons, isto é, 10. Já o cátion sódio tinha onze elétrons no estado fundamental, mas sua carga (1+) indica que ele perdeu um elétron, ficando, assim, com dez. Por fim, o ânion oxigênio tinha oito elétrons no estado fundamental, mas sua carga indica que ele ganhou dois, ficando, portanto, com dez elétrons. Assim, esses três exemplos possuem dez elétrons, sendo, portanto, isoeletrônicos entre si.
Por Jennifer Fogaça
Graduada em Química
Videoaulas relacionadas: