As bases inorgânicas, segundo o conceito de eletrólitos de Arrhenius, são substâncias capazes de se dissociar em água, liberando como único cátion a hidroxila OH-.
Baseado nesse conceito, uma das formas de se classificar as bases é com respeito à quantidade de cátions OH-. Veja:
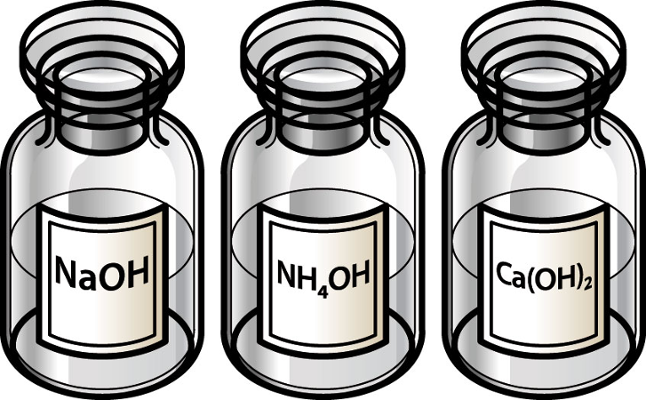
* Monobase: possui apenas um íon OH-. Exemplos: NaOH, KOH, NH4OH, AgOH, CuOH;
* Dibase: possui dois íons OH-. Exemplos: Zn(OH)2, Sr(OH)2, Ca(OH)2, Fe(OH)2, Ba(OH)2, Cu(OH)2, Mg(OH)2;
* Tribase: possui três íons OH-. Exemplos: Al(OH)3, Fe(OH)3;
* Tetrabase: possui quatro íons OH-. Exemplos: Pb(OH)4, Sn(OH)4.
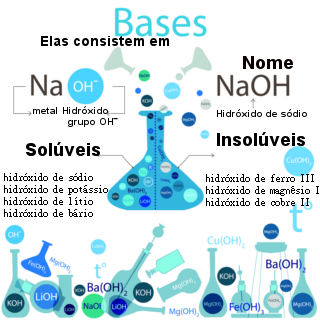
Outra forma de se classificar as bases é quanto à sua solubilidade em água:
* Solúveis: Bases de metais alcalinos (em que o elemento ligado à hidroxila é da família 1 da Tabela Periódica, tais como: LiOH, NaOH e KOH);
* Pouco solúveis: Bases de metais alcalinoterrosos (em que o elemento ligado à hidroxila é da família 2 da Tabela Periódica, tais como: Sr(OH)2, Ca(OH)2e Ba(OH)2). A única exceção é o Mg(OH)2, que é praticamente insolúvel;
* Praticamente insolúveis: As bases dos demais metais e o Mg(OH)2.
A ordem de solubilidade dos metais alcalinos e dos metais alcalinoterrosos aumenta conforme o aumento do período na Tabela Periódica:
Metais alcalinos: LiOH < NaOH < KOH < RbOH < CsOH
Metais alcalinoterrosos: Be(OH)2 < Ca(OH)2 > Sr(OH)2 < Ba(OH)2< Ra(OH)2
Uma base peculiar e que é bastante solúvel em água é o hidróxido de amônio (NH4OH). Ele é tão solúvel em meio aquoso que alguns cientistas consideram que ele não existe, mas que, na verdade, seria o gás amônia (NH3(g)) dissolvido em água.
NH3(g)+ H2O(l) → NH3 . H2O(aq) → NH4+(aq) + OH-(aq)
A solubilidade das bases está intimamente relacionada com outro tipo de classificação, que inclusive é considerada a mais importante porque indica a força dela: classificação quanto ao grau de dissociação (α), que é dado por:
α = quantidade de fórmulas unitárias da base que se dissociam (formam íons)
quantidade de fórmulas unitárias da base que foram dissolvidas no início
Considerando a temperatura em 18ºC, temos que:
* Base forte: α > 50%. Exemplos: bases de metais alcalinos e de alguns metais alcalinoterrosos;
* Base fraca: α < 5%. Exemplos: Bases de metais de transição, dos metais das famílias 13, 14 e 15 da tabela periódica, o hidróxido de magnésio (Mg(OH)2) e o hidróxido de amônio (NH4OH).
Geralmente, as bases mais solúveis são as mais fortes, como ocorre com o hidróxido de sódio (NaOH) que é bastante solúvel e possui grau de dissociação igual a 95%. No entanto, o hidróxido de amônio (NH4OH) é uma exceção, porque, apesar de ser muito solúvel, possui um grau de dissociação muito pequeno.
Por Jennifer Fogaça
Graduada em Química
Aproveite para conferir nossas videoaulas sobre o assunto: