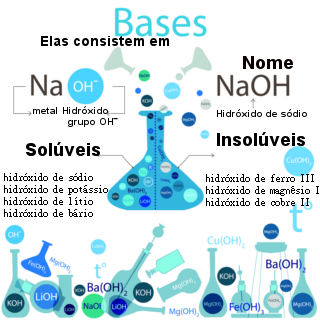
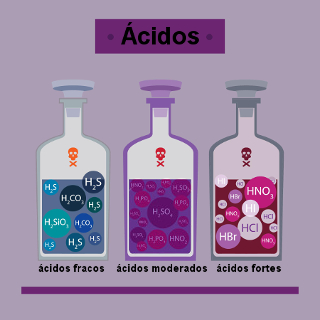
Quando uma base é adicionada à água, de acordo com o químico sueco Arrhenius, ela sofre o fenômeno da dissociação (liberação de íons), e a quantidade de íons liberada é expressa por uma grandeza denominada grau de dissociação (α).
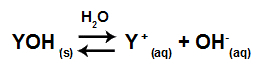
Equação representando a dissociação de uma base
Ao dissociar, a base libera um cátion (metálico-Y+ ou o amônio-NH4+) e o ânion hidróxido (OH-1), e a quantidade liberada desses íons é indicada pelo grau de dissociação. Assim, quanto maior o grau, mais a base irá dissociar e maior será a quantidade de íons liberados na água.
Baseando-se nesse fato, foi criada uma fórmula para calcular o grau de dissociação de uma base, na qual o número de unidades dissociadas é dividido pelo número de unidades adicionadas em água.
Interpretação do grau de dissociação das bases
O grau de dissociação é a grandeza utilizada para expressar a força de uma base, ou seja, sua capacidade de conduzir corrente elétrica, a qual depende da quantidade de íons liberados na dissociação.
Obs.: Quanto maior a quantidade de íons em água, maior a sua capacidade em conduzir corrente elétrica.
Sempre que o grau de dissociação for calculado, deve-se, em seguida, multiplicar o resultado por 100, pois essa grandeza apresenta-se como porcentagem. Por meio dessa porcentagem, é possível determinar a força da base segundo os critérios a seguir:
-
Base forte: quando o α for maior que 5 % (mais de 5% das unidades da base adicionadas em água dissociam, ou seja, há mais íons na água);
Não pare agora... Tem mais depois da publicidade ;) -
Base fraca: quando o α for menor ou igual a 5% (5% ou menos das unidades da base adicionadas em água dissociam, ou seja, há poucos íons na água).
Exemplos de cálculo de dissociação das bases
1º Exemplo: Uma certa base YOH possui cerca de oito moléculas dissociadas em água quando 60 são adicionadas em água. Qual o seu grau de dissociação?
Como três unidades da base foram dissociadas, de 60 adicionadas na água, para determinar o grau de dissociação, basta utilizar os valores fornecidos na expressão a seguir:
α = no de unidades dissociadas
no de unidades adicionadas
α = 3
60
α = 0,05
ou
α = 5 % (ao multiplicar o valor encontrado por 100)
2º Exemplo: Quando 300 unidades de uma base são adicionadas em água, porém apenas 90 delas são dissociadas, qual a classificação que essa base deve receber?
O enunciado informa que 90 unidades da base foram dissociadas, de 300 adicionadas na água, para determinar o grau de dissociação, basta utilizar os valores fornecidos na expressão a seguir:
α = no de unidades dissociadas
no de unidades adicionadas
α = 90
300
α = 0,3
ou
α = 30 % (ao multiplicar o valor encontrado por 100)
Como o grau de dissociação da base é maior que 5 %, ela deve ser considerada forte.
Por Me. Diogo Lopes Dias
Videoaulas relacionadas: