No texto “Reações Reversíveis e Equilíbrio Químico”, quando uma reação reversível encontra-se em um sistema fechado, ela acaba por entrar em equilíbrio químico, ou seja, as taxas de desenvolvimento das reações direta e inversa ocorrem com a mesma velocidade. Se não houver nenhuma alteração no sistema, ele permanecerá indefinidamente assim.
O cientista francês Henry Louis Le Chatelier (1850-1936) percebeu isso e passou a estudar esse fenômeno. Ele dedicou-se ao estudo de possíveis maneiras de se conseguir deslocar o equilíbrio químico e descobriu aspectos importantes que são até hoje usados por indústrias, por exemplo, para aumentar a produção de determinados produtos com menor custo.
Uma das coisas que ele descobriu foi o que passou a ser chamado de Princípio de Le Chatelier, que pode ser enunciado da seguinte maneira:
“Quando se provoca uma perturbação em um sistema em equilíbrio, este se desloca no sentido que tende a anular essa perturbação, procurando se ajustar a um novo equilíbrio.”
Os principais fatores que causam esse deslocamento no equilíbrio químico são: concentração dos reagentes ou produtos participantes da reação, pressão e temperatura.
O uso de catalisadores apenas acelera a velocidade das reações, isto é, no caso de reações reversíveis, faz com que elas atinjam o equilíbrio mais rapidamente. Mas os catalisadores não interferem no deslocamento do equilíbrio, pois eles atuam igualmente tanto no sentido da reação direta quanto no sentido da reação inversa.
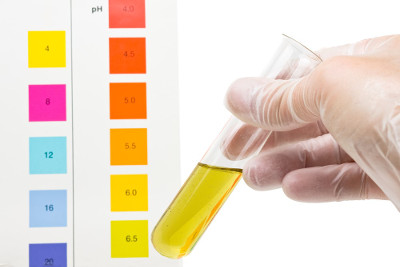
Consideremos um exemplo em que haverá variação na concentração: temos o seguinte sistema aquoso em que os íons abaixo estão em equilíbrio químico:
2 CrO42-(aq) + 2 H+(aq) ↔ 2 Cr2O72-(aq) + 2 H2O(l)
Os íons CrO42- conferem a cor amarela ao sistema, enquanto os íons Cr2O72- conferem a cor alaranjada.
Assim, imagine que adicionemos algumas gotas de limão a esse sistema. Visto que o limão é ácido, estaríamos aumentando a concentração dos íons H+(aq). Seguindo o princípio de Le Chatelier, o sistema irá, então, deslocar-se no sentido de consumir os íons H+, ou seja, no sentido da reação direta (para a direita). Isso provocaria mais produção dos íons Cr2O72- e a solução passaria de amarela para o alaranjado.

Exemplo de deslocamento de equilíbrio segundo o Princípio de Le Chatelier
O contrário também é verdadeiro, se adicionarmos alguma solução básica ao meio, os íons OH- dessa solução irão reagir com os íons H+ e haveria o aumento da concentração da água (H2O(?)) no meio. Por isso, o equilíbrio se deslocaria no sentido de consumir a água, ou seja, para a esquerda, no sentido inverso, e o sistema líquido ficaria amarelo.
Por meio desse exemplo, podemos generalizar o seguinte:
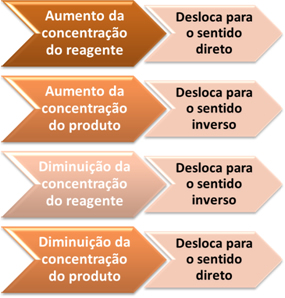
Variação da concentração e deslocamento do equilíbrio
Quanto à variação da pressão e da temperatura, podemos dizer o seguinte:
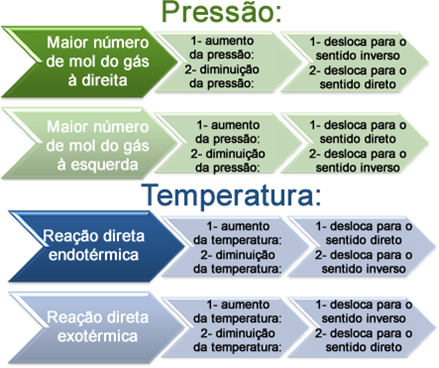
Variação da pressão e da temperatura e deslocamento do equilíbrio químico
Por Jennifer Fogaça
Graduada em Química
Videoaulas relacionadas: