Solução-tampão é uma mistura formada por um ácido ou por uma base fracos inorgânicos e por um sal inorgânico que apresente o mesmo ânion do ácido ou o mesmo cátion da base.
A principal característica de uma solução-tampão é o fato de seu pH manter-se praticamente inalterado, mesmo que acrescido de uma certa quantidade de solução contendo um ácido ou uma base fortes.
1- Formação de uma solução-tampão
Eletrólitos são substâncias que, quando adicionadas em água, sofrem dissociação (liberam íons) ou ionização (produzem íons). No caso da solução-tampão, além dos sais, são utilizados outro eletrólito: um ácido ou uma base fracos. Abaixo, aprenderemos como reconhecer esses eletrólitos fracos.
1.1- Ácidos fracos
Hidrácidos fracos
São todos os ácidos que não apresentam oxigênio na sua composição e que não têm os ânions cloreto (Cl-), brometo (Br-), iodeto (I-) ou o fluoreto (F-).
Oxiácidos fracos
São todos os ácidos que apresentam oxigênio na sua composição. Nesses compostos, a subtração da quantidade de oxigênios pela quantidade de hidrogênios deverá resultar em zero. Observe o exemplo do ácido bórico (H3BO3):
|
oxigênio – hidrogênio O3 – H3 3 – 3 0 |
Obs.: o ácido carbônico (H2CO3), apesar de não seguir a regra proposta, é um oxiácido fraco.
Veja também: Força dos ácidos
1.2- Bases fracas
Uma base é considerada fraca quando não apresenta metal alcalino (elemento pertencente à família IA da tabela periódica) ou metal alcalinoterroso (elemento pertencente à família IIA da tabela periódica).
Obs.: o elemento magnésio (Mg), apesar de ser um metal alcalinoterroso, forma uma base fraca.
Veja também: Força das bases
2- Comportamento e pH de uma solução-tampão
As soluções-tampão podem ser ácidas ou básicas, característica associada ao seu pH (potencial hidrogeniônico ou concentração de íons H+ de um meio).
Na teoria do pH, meio ácido é aquele que apresenta pH menor que 7, enquanto meio básico é aquele que apresenta pH maior que 7. Essas referências são também utilizadas para as soluções-tampão.
2.1- Solução-tampão ácida
Uma solução-tampão ácida é aquela constituída por um ácido fraco, como o ácido sulfídrico (H2S), e por um sal que apresente o mesmo ânion do ácido, como o sulfeto de potássio (K2S).
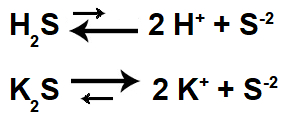
Equações de ionização e de dissociação da solução-tampão ácida.
Analisando as equações, observa-se que o ácido, por ser fraco, ioniza pouco (seta menor), enquanto o sal, por ser solúvel, dissocia bastante (seta maior).
O valor do pH de uma solução-tampão ácida é sempre menor que 7. Por apresentar um ácido fraco, no entanto, o pH dessa solução não será muito abaixo desse valor. Ao receber ácido ou base fortes, seu pH não sofrerá grandes alterações.
2.1.1- Adição de ácido forte
Suponhamos, por exemplo, que o ácido bromídrico (HBr) seja adicionado na solução-tampão ácida H2S/K2S:
.jpg)
Equação que representa a ionização de um ácido forte.
Quando se adiciona ácido bromídrico na solução-tampão, há um acréscimo do íon H+, que já existe no meio. Esse íon irá interagir com o ânion Br-, formando HBr. O aumento da quantidade de bromídrico desencadeará o aumento de sua ionização e a reposição dos íons Br-. Por isso, o pH permanece inalterado.
2.1.2- Adição de uma base forte
Suponhamos que o hidróxido de sódio (NaOH) seja adicionado na solução-tampão ácida H2S/K2S:
.jpg)
Equação que representa a dissociação de uma base forte.
Quando essa base é adicionada nessa solução-tampão, há também a adição do íon hidróxido (OH-), o qual tem afinidade com o hidrônio H+, existente no meio. Esses íons unem-se, formando água (H2O). Esse fato amplia a ionização do ácido, repondo os hidrônios gastos e mantendo o pH inalterado.
2.2- Composição e pH de uma solução-tampão básica
Uma solução-tampão básica é aquela constituída por uma base fraca, como o hidróxido de alumínio [Al(OH)3], e por um sal que apresente o mesmo ânion do ácido, como o cloreto de alumínio (AlCl3).
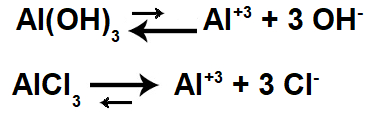
Equações de dissociação da solução-tampão básica.
O valor do pH de uma solução-tampão básica é sempre maior que 7. Por apresentar uma base fraca, essa solução não terá um pH muito acima desse valor. Ao receber ácido ou base fortes, seu pH não sofrerá grandes alterações.
2.2.1- Adição de ácido forte
Suponhamos, por exemplo, que o ácido bromídrico (HBr) seja adicionado na solução-tampão básica Al(OH)3/AlCl3:
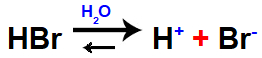
Equação que representa a ionização de um ácido forte.
Quando essa base é adicionada nessa solução-tampão, há o acréscimo do íon hidrônio (H+), o qual tem afinidade com o hidróxido (OH-), existente no meio. Esses íons unem-se, formando água (H2O). Esse fato amplia a dissociação da base, repondo os íons hidróxido e mantendo o pH inalterado.
2.2.2- Adição de uma base forte
Suponhamos, por exemplo, que o hidróxido de sódio (NaOH) seja adicionado na solução-tampão básica Al(OH)3/AlCl3:
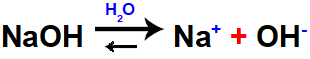
Equação que representa a dissociação de uma base forte.
Quando essa base é adicionada nessa solução-tampão, adiciona-se também uma quantidade do íon hidróxido (OH-), o qual já existente no meio. Esses íons unem-se ao cátion alumínio (Al+3), formando hidróxido de alumínio [Al(OH)3]. Esse fato amplia a dissociação da base, repondo os cátions alumínio gastos e mantendo o pH inalterado.
3- Fórmulas na solução-tampão
No estudo de solução-tampão, as fórmulas utilizadas têm como objetivo a determinação seu valor de pH. Existem três fórmulas usadas para o cálculo do pH de soluções-tampão: fórmula para solução-tampão ácida, fórmula para solução-tampão básica e fórmula geral.
Fórmula do pH de solução-tampão ácida
![pKa = -log [constante de ionização do ácido] [sal] = concentração mol/L do sal na solução [ácido] = concentração mol/L do ácido na solução](https://static.manualdaquimica.com/conteudo/images/2018/11/formula-do-pH-de-um-tampao-acido.jpg)
pKa = -log [constante de ionização do ácido]
[sal] = concentração mol/L do sal na solução
[ácido] = concentração mol/L do ácido na solução
Fórmula do pH de solução-tampão básica
![pKb = -log [constante de ionização da base] [base] = concentração mol/L da base na solução](https://static.manualdaquimica.com/conteudo/images/2018/11/formula-do-pH-de-um-tampao-basico(1).jpg)
pKb = -log [constante de ionização da base]
[base] = concentração mol/L da base na solução
Obs.: para calcularmos o pH de uma solução-tampão a partir do valor do pOH, basta utilizarmos a expressão abaixo:
|
pH + pOH = 14 |
Fórmula geral do pH de solução-tampão
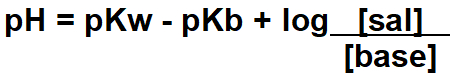
pKw = -log (constante de ionização da água ou 10-14, a 25oC)
4- Solução-tampão e Bioquímica
A Bioquímica estuda as estruturas (vitaminas, proteínas, carboidratos, etc), a organização e as transformações moleculares que ocorrem na célula (metabolismo) e no meio onde as células estão inseridas. Esses fatores são fundamentais para garantir a sobrevivência, o crescimento e a reprodução dos organismos vivos.
Nas células e fora das células, ocorrem várias reações químicas para a manutenção do organismo vivo. Essas reações, porém, só ocorrem em uma faixa de pH adequada.
As soluções-tampão têm um papel importante na manutenção do pH, tanto intracelular quanto do meio extracelular, para o funcionamento de todo o sistema biológico. Existem várias soluções-tampão em um organismo vivo:
-
Solução-tampão formado por ácido carbônico e bicarbonato de sódio, substâncias presentes no sangue;
-
Solução-tampão com a mistura tris-acetato, usada para separar o DNA do RNA;
-
Solução-tampão de histidina, de glicina e de citrato, soluções-tampão enzimáticas que participam do metabolismo.
5- Aplicações das soluções-tampão
5.1- Biológicas
-
O sangue é uma solução-tampão formada, principalmente, por substâncias como ácido carbônico (H2CO3) e ânion bicarbonato (HCO3-).
-
Os sistemas enzimáticos relacionados com a proteína histidina também são soluções-tampão.
5.2- Químicas
-
Reações de precipitação, nas quais os produtos formados precipitam na forma de um sólido em virtude da variação no pH do meio, são soluções-tampão.
-
Reações eletródicas, que ocorrem em uma pilha ou em uma eletrólise, são também soluções-tampão.
5.3- Biotecnológicas
-
Eletroforese: solução-tampão com a presença da substância tris-acetato, que permite a separação do RNA e do DNA da célula.
-
Quebra do DNA: durante a extração e quebra do DNA, deve haver uma solução-tampão capaz de mantê-lo íntegro.
-
Lavagem de células: solução-tampão formado por sal e fosfato que tem a função de manter o meio onde as células estão com condições próximas àquelas encontradas no corpo humano.
6- Solução-tampão e o sangue
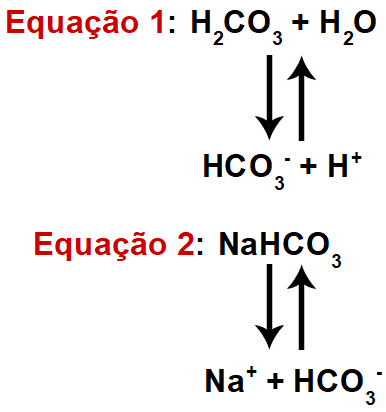
O sangue apresenta uma solução-tampão denominada bicarbonato. Nela temos a presença de duas substâncias: o ácido carbônico (H2CO3) e o bicarbonato de sódio (NaHCO3), cada qual com sua equação de ionização:
Observe que essa solução-tampão apresenta um ácido fraco (H2CO3 ) e o sal (NaHCO3). Essa solução é levemente básica, já que o valor do seu pH varia de 7,35 a 7,45.
6.1- Situação de acidez
Uma situação de acidez pode ocorrer quando os pulmões não conseguem eliminar o dióxido de carbono (CO2) produzido na respiração celular ou quando ocorre uma maior produção de ácidos por processos metabólicos.
Em presença de maior acidez, ou seja, maior concentração de H+, o equilíbrio 1 é deslocado para a esquerda, formando o H2CO3. Imediatamente, esse ácido, que é instável, é transformado em CO2 e H2O.
Para tentar corrigir essa acidez no sangue, o corpo aumenta a frequência respiratória para eliminar o CO2, enquanto os rins retêm parte do bicarbonato para interagir com o excesso de H+.
6.2- Situação de basicidade
A situação de basicidade ou alcalose ocorre quando há um excesso de base, provocado por uma hiperventilação pulmonar, eliminando um maior volume de dióxido de carbono. Pode ser provocada ainda pelo metabolismo em virtude de alterações em íons importantes, como cloreto e potássio.
Em presença de maior basicidade ou alcalose, ou seja, em menor concentração de H+, o equilíbrio 1 é deslocado para a direita, ionizando o H2CO3. O corpo diminui a frequência respiratória para eliminar menos CO2, enquanto os rins liberam mais bicarbonato.
7- Resumo
-
Solução-tampão é formado por um ácido fraco misturado a um sal que possua o mesmo ânion ou por uma base fraca com um sal de mesmo cátion.
-
Ao receber um ácido ou uma base forte, a solução-tampão ácida tem a tendência de manter seu pH inalterado.
-
Ao receber um ácido ou uma base forte, a solução-tampão básica tem a tendência de manter seu pH inalterado.
-
Solução-tampão ácido é aquele que apresenta pH inferior a 7, enquanto uma solução-tampão básica é aquele que apresenta um pH superior a 7.
-
Para calcular o pH ou o pOH de uma solução-tampão, utilizam-se a concentração do sal, da base ou do ácido e a constante de ionização do ácido ou da base.
-
A solução-tampão tem por objetivo manter o pH dos meios intra e extracelulares com pH não variante para que as reações químicas necessárias à manutenção da vida possam ocorrer normalmente.
-
Soluções-tampão podem ser utilizados em eletroforese, quebra de DNA, lavagem de células, reações eletródicas e de precipitação, etc.
-
No sangue, há um equilíbrio de H2CO3 (que forma CO2 e H2O) e o NaHCO3 (que forma H+ e HCO3-).
8- Exercícios sobre solução-tampão
Exercício 1- (FESP-PE) Considere as substâncias abaixo:
I. CH3CH2OH
II. CH3COONa
III. NH4OH
IV. H2CO3
V. CH3COOH
As duas substâncias que você usaria para, convenientemente, preparar uma solução-tampão seriam:
a) I e II
b) II e III
c) II e V
d) I e V
e) IV e V
Resposta correta: Letra C
Para preparar uma solução-tampão, é necessária a realização da mistura de um ácido fraco com um sal que apresente o mesmo ânion do ácido ou de uma base fraca e um sal que apresente o mesmo cátion da base.
No exercício, encontramos essas condições ao juntar as substâncias presentes nos itens II (sal de mesmo ânion CH3COONa) e V (ácido fraco CH3COOH).
Exercício 2- (UNIRIO-RJ) Indique a opção em que são apresentadas as substâncias que podem compor uma solução-tampão ácida:
a) HNO3 e NaNO3
b) HI e KI
c) HCOOH e HCOO- Na+
d) NH4OH e NH4NO2
e) H3PO4 e Al(NO3)3
Resposta correta: Letra C
Para compor uma solução-tampão ácida, são necessários um ácido fraco e um sal que apresente o mesmo ânion do sal. Essa característica é encontrada nas substâncias presentes na alternativa C: ácido fraco (HCOOH) e um sal com mesmo ânion (HCOO- Na+).
Exercício 3- Qual é o pH de uma solução-tampão de 0,12 mol/L de ácido lático (HC3H5O3) e 0,10 mol/L de lactato de sódio (NaC3H5O3)?
Dado: Ka = 1,4 x 10-4.
Os dados fornecidos pelo exercício foram:
-
Concentração do ácido (HC3H5O3) = 0,12 mol/L
-
Concentração do sal (NaC3H5O3) = 0,10 mol/L
-
Ka = 1,4 x 10-4