Existem várias formas de classificar as soluções químicas, que são misturas homogêneas, mas uma das mais importantes é quanto à sua propriedade de conduzirem ou não corrente elétrica.
As soluções que não possuem a capacidade de conduzir corrente elétrica são chamadas de soluções não eletrolíticas ou soluções moleculares. Esse tipo de solução é proveniente da dissolução de alguma substância molecular que não sofre ionização.
Um exemplo é uma solução formada por açúcar dissolvido na água. As moléculas de açúcar (sacarose —C12H22O11) são moleculares porque são formadas somente por ligações covalentes entre seus átomos. Essas moléculas unem-se e formam aglomerados que ficam visíveis na forma de cristais.
Mas quando colocamos o açúcar na água, esses aglomerados se desfazem, isto é, as moléculas se separam e ficam na sua forma isolada, de modo que não as vemos a olho nu. Por exemplo, se adicionamos 1 mol de sacarose na água, teremos no final 1 mol de sacarose, o que equivale a dizer que no início tínhamos 6,0 . 1023 moléculas unidas, mas no final ficamos com 6,0 . 1023 moléculas separadas.
Essas moléculas ficam dispersas no solvente e como não possuem carga elétrica, elas não são capazes de conduzir corrente elétrica.
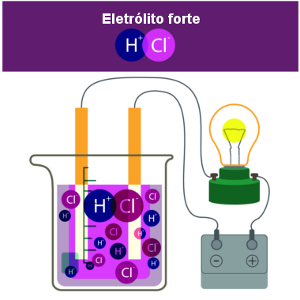
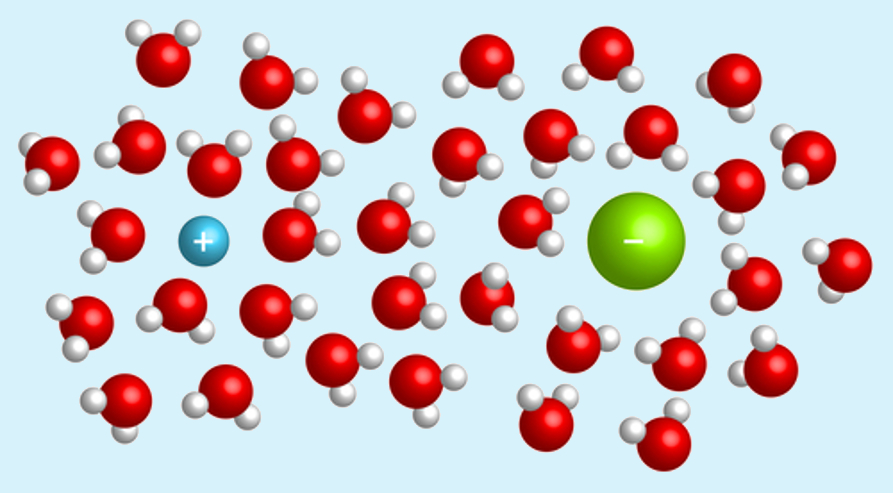
Por outro lado, as soluções capazes de conduzir corrente elétrica são chamadas de soluções eletrolíticas ou soluções iônicas, pois a condutibilidade deve-se à presença de íons no meio.
Esses íons podem ser provenientes de dois processos:
* Dissociação iônica: ocorre quando é dissolvido um composto iônico. Por exemplo, o sal de cozinha (NaCl – cloreto de sódio) é formado por íons sódio (Na+) e cloreto (Cl-), que são unidos por uma ligação iônica, ou seja, eles ligaram-se por uma transferência de elétrons que fez com que os átomos transformassem-se em íons (o sódio perdeu um elétron, ficando com carga +1, e o cloro ganhou um elétron, ficando com carga -1).
Mas quando o cloreto de sódio é adicionado à água, a parte positiva das moléculas de água atrai o Cl-, e a parte negativa da água atrai o Na+, separando-os. Dessa forma, esses íons ficam dispersos na solução.
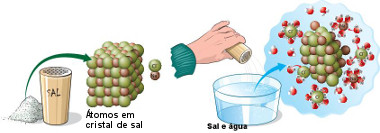
Dissociação iônica do sal na água
* Ionização: Ocorre quando um soluto molecular reage com a água e formam-se íons que não existiam antes no composto.
Por exemplo, o HCl é formado por uma ligação covalente (compartilhamento de um par de elétrons), portanto, é molecular. Mas ao ser colocado na água, ele é separado e forma os íons H+ e Cl-.