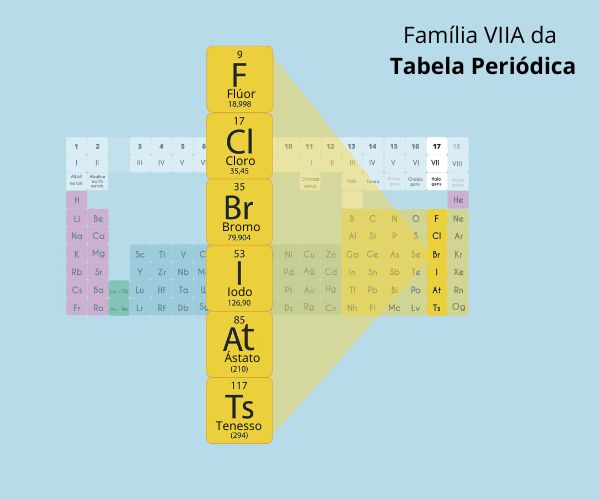
Família do nitrogênio, grupo 15 ou família V A é o nome dado à décima quinta coluna vertical da tabela periódica (composta por dezoito colunas verticais), onde estão localizados os seguintes elementos químicos:
-
Nitrogênio (sigla N e número atômico 7);
-
Fósforo (sigla P e número atômico 15);
-
Arsênio (sigla As e número atômico 33);
-
Antimônio (sigla Sb e número atômico 51);
-
Bismuto (sigla Bi e número atômico 83);
-
Moscóvio (sigla Mc e número atômico 115).
1- Características atômicas dos elementos da família do nitrogênio
-
Todos os elementos pertencentes à família do nitrogênio possuem átomos que apresentam cinco elétrons na camada de valência (último nível do átomo), como podemos observar na distribuição eletrônica de cada um deles:
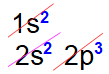
Distribuição eletrônica referente ao nitrogênio (número atômico 7)

Distribuição eletrônica referente ao fósforo (número atômico 15)

Distribuição eletrônica referente ao arsênio (número atômico 33)

Distribuição eletrônica referente ao antimônio (número atômico 51)

Distribuição eletrônica referente ao bismuto (número atômico 81)

Distribuição eletrônica referente ao moscóvio (número atômico 115)
-
A análise dessas distribuições eletrônicas indica que não existe nenhum elemento nessa família com apenas uma camada ou nível eletrônico.
-
O subnível mais externo (mais distante do núcleo) e o mais energético (que apresenta maior quantidade de energia) dos elementos é sempre o p3, modificando apenas o nível eletrônico em que esse subnível encontra-se.
-
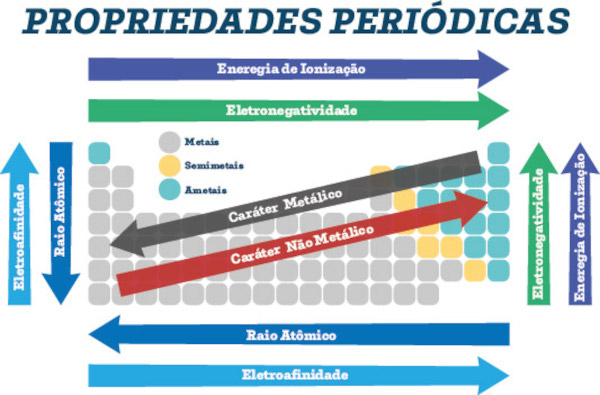
O número de níveis aumenta do nitrogênio em direção ao moscóvio, sendo este o elemento com átomos de maior tamanho ou raio atômico.
-
O elemento nitrogênio, por apresentar o menor número de níveis eletrônicos (dois), é o elemento de maior energia de ionização (energia necessária para retirar um elétron de um átomo), pois seus elétrons estão mais próximos do núcleo (região do átomo que promove atração dos elétrons). Logo, a energia de ionização aumenta do moscóvio em direção ao nitrogênio.
-
Como as propriedades eletronegatividade e afinidade eletrônica estão relacionadas com o raio atômico (quanto menor o raio, maior elas serão) e com a energia de ionização (quanto maior a energia, maior elas serão), podemos afirmar que elas aumentam do moscóvio em direção ao nitrogênio.
Não pare agora... Tem mais depois da publicidade ;)
2- Propriedades físicas
Nitrogênio, fósforo e arsênio são ametais, por isso não conduzem corrente elétrica, não conduzem calor, têm baixo ponto de fusão e de ebulição, possuem tendência a ganhar elétrons e, consequentemente, a formar ânion.
Veja também: Íons
Os ametais da família do nitrogênio formam substâncias moleculares (formadas por ligações covalentes). Como apresentam cinco elétrons na camada de valência, esses elementos devem realizar três ligações para se tornarem átomos estáveis.
Veja também: Teoria do octeto
Antimônio, bismuto e moscóvio são metais, por isso possuem brilho metálico, conduzem corrente elétrica e calor, têm elevado ponto de fusão e de ebulição, possuem tendência a perder elétrons e, consequentemente, a formar cátion.
Os metais da família do nitrogênio formam substâncias iônicas (formadas por ligações iônicas) e, para se tornarem átomos estáveis, devem perder elétrons de valência.
Com exceção do nitrogênio, todos os outros elementos são sólidos à temperatura ambiente, e o moscóvio é o único elemento considerado radioativo.
3- Abundância
-
Com exceção do nitrogênio e do moscóvio, todos os outros elementos da família do nitrogênio são encontrados na natureza associados a outros elementos na formação de diferentes minerais.
-
O nitrogênio é encontrado, principalmente, na atmosfera e faz parte de 78% da sua composição. Já o moscóvio é um elemento sintético, ou seja, não existe na natureza, foi produzido em laboratório.
Veja também: Novos elementos da tabela periódica
4- Utilizações dos elementos da família do nitrogênio
4.1- Nitrogênio
O nitrogênio é utilizado para várias finalidades, entre elas na produção de aço inoxidável, como material para refrigerar outros durante um transporte ou durante armazenamento por longo tempo, na produção de fertilizantes, etc.

Espermatozoides armazenados em um tanque com nitrogênio líquido
4.2- Fósforo
O fósforo pode ser utilizado na produção de fertilizantes, na produção de confeitos para confeitaria, na produção do aço, etc.
4.3- Arsênio
O arsênio pode ser utilizado na conservação de couro, na produção da liga metálica chamada latão, na produção de inseticidas, etc.
4.4- Antimônio
O antimônio pode ser utilizado na produção de medicamentos contra a leishmaniose, na produção de baterias, na produção de esmaltes, etc.
4.5- Bismuto
O bismuto pode ser utilizado na produção de alguns medicamentos de ação gastrointestinal, na produção de metanol, de corantes, de fusíveis, etc.
4.6- Moscóvio
Por ser um elemento sintético desenvolvido há pouco tempo, ainda não apresenta uma aplicação.