As transformações gasosas sempre ocorrem com uma das variáveis de estado dos gases mantida constante, enquanto as demais sofrem variação. No caso da transformação isobárica, a variável que permanece constante é a pressão (P), já a temperatura e o volume variam.
Imagine que coloquemos uma bexiga vazia na boca de uma garrafa PET. Se mergulharmos essa garrafa em um recipiente com água quente, a bexiga inflará. Por outro lado, se colocarmos a garrafa em contato com água gelada, a bexiga murchará.
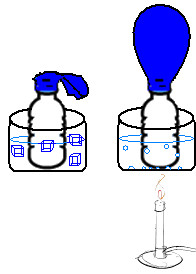
Experimento de balão na garrafa para demonstrar a relação entre temperatura e volume
Nesse experimento, a pressão manteve-se contante, mas quando aumentamos a temperatura (água quente), o volume da mistura gasosa (ar) dentro da garrafa PET também aumentou, ou seja, expandiu-se e fez o balão inflar. O contrário aconteceu quando diminuímos a temperatura (água gelada), isto é, a mistura gasosa contraiu-se e o volume ocupado por ela diminuiu.
Esse é um exemplo de transformação isobárica e mostra-nos o seguinte:
“Em um sistema sob pressão contante, observa-se que o volume ocupado por determinada massa fixa de gás é diretamente proporcional à temperatura termodinâmica.”
Essa lei é conhecida por primeira lei de Charles e Gay-Lussac, pois ela foi inicialmente observada em 1787 pelo físico francês Jacques Charles (1746-1823) e, em 1802, foi quantificada pelo químico francês Joseph Gay-Lussac (1778-1850).
Essa quantificação mostrou que se aumentarmos a temperatura para o dobro do seu valor inicial, o volume também aumentará exatamente o dobro, e se diminuirmos pela metade a temperatura, o volume ocupado pelo gás também diminuirá a metade. É importante ressaltar que isso só vale se a temperatura for a termodinâmica, isto é, na escala Kelvin.
Isso acontece porque o aumento da temperatura eleva também a energia cinética das moléculas ou átomos do gás, o que faz com que elas movimentem-se ainda mais rapidamente, expandindo o volume. Mas quando a temperatura diminui, as partículas constituintes do gás movimentam-se mais lentamente, e o gás contrai-se.
Sempre que duas grandezas são diretamente proporcionais, matematicamente temos que a razão entre elas é igual a uma constante:
V = k
T
Para verificar se isso é verdade, considere os dados mostrados na tabela a seguir que foram obtidos em transformações isobáricas:
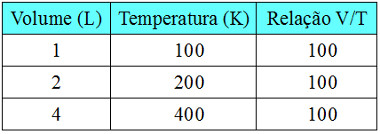
Dados obtidos em transformação isobárica
Colocando os dados mostrados acima em um gráfico, temos o seguinte:
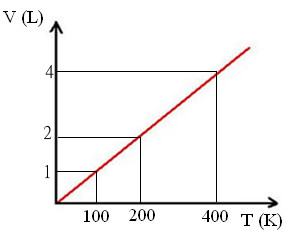
Gráfico de transformação isobárica segundo a lei de Charles e Gay-Lussac
Em todos os gráficos de transformações isobáricas, obtemos uma reta, pois o volume varia proporcionalmente com a temperatura e vice-versa.
Observe que o volume e a temperatura aumentaram proporcionalmente e que a relação V/T deu o mesmo valor em todos os casos, ou seja, é uma constante. Com base nisso, podemos representar essa relação também da seguinte forma:
Vinicial = Vfinal
Tinicial Tfinal
Veja agora um exemplo de como podemos usar essa relação matemática para resolver problemas relacionados com transformações gasosas:
Exemplo: “(UnB-DF) Um volume igual a 30 mL de gás metano a 25ºC é aquecido a 35ºC, à pressão constante. Calcule o novo volume do gás.”
Resolução:
Dados:
Tinicial = 25º C + 273 = 298 K
Tfinal = 35º C + 273 = 308 K
Vinicial = 30 mL
Vfinal = ?
Aplicando na fórmula, temos:
Vinicial = Vfinal
Tinicial Tfinal
30 = Vfinal
298 308
Vfinal = 30 . 308
298
Vfinal = 31 mL
Esse é o volume novo ocupado pelo gás com o aumento da temperatura.
Por Jennifer Fogaça
Graduada em Química