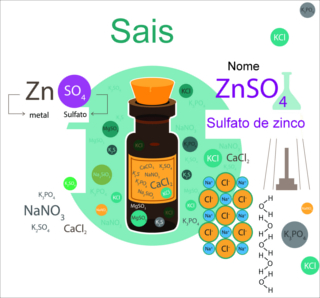
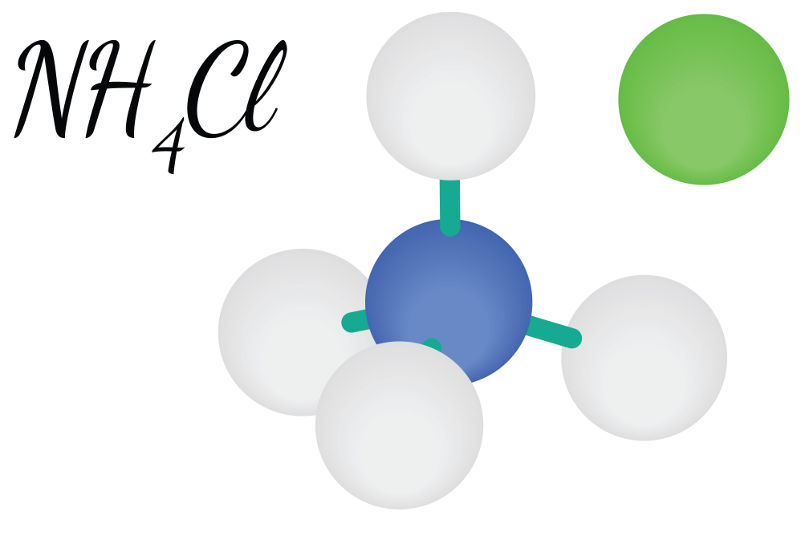
Os sais são compostos inorgânicos iônicos, formados por um cátion diferente do hidrônio (H3O+) e um ânion diferente da hidroxila (OH-1). Mesmo sendo compostos Iônicos (sofrem dissociação em água), eles podem ser solúveis ou praticamente insolúveis em água.
Observação: É importante ressaltar que não existe nenhum sal insolúvel, assim estamos afirmando que uma quantidade muito pequena dele se dissolve em água.
Dessa forma, todo sal ao entrar em contato com a água irá sofrer dissociação iônica. A diferença é que os sais considerados solúveis liberam uma quantidade de íons maior que a liberada pelos sais insolúveis.
Abaixo temos um exemplo de uma equação que representa a dissociação do sal cloreto de cálcio em água:
CaCl2(aq) → Ca+2(aq) + 2 Cl-1(aq)
Dissociação do cloreto de cálcio (CaCl2) em água
A solubilidade está muito relacionada com as interações elétricas entre as moléculas do solvente que utilizamos para dissolver um determinado material. Por isso, a dissociação ou dissolução segue os princípios abaixo:
-
Interação da molécula do solvente com a molécula do solvente (água).
-
Interação entre a molécula do solvente e a molécula do soluto (sal).
-
Interação entre a molécula do solvente e os íons do soluto.
-
Interação entre os íons do soluto.
A dissociação vai acontecer quando as interações elétricas entre as moléculas de água e os íons do sal forem mais fortes que as interações entre os íons do sal propriamente dito.
Porém, neste momento você deve estar se perguntado: Mas como eu faço pra saber se um determinado sal é solúvel ou praticamente insolúvel? Na realidade essa pergunta pode ser respondida de forma muito simples, pois existe uma tabela de solubilidade para sais. No entanto, decorar ou memorizar uma tabela é extremamente cansativo e desanimador.
Para facilitar o seu trabalho de reconhecimento, basta seguir o quadro demonstrativo abaixo, que irá ajudá-lo de forma bastante eficaz. Conheça-o:
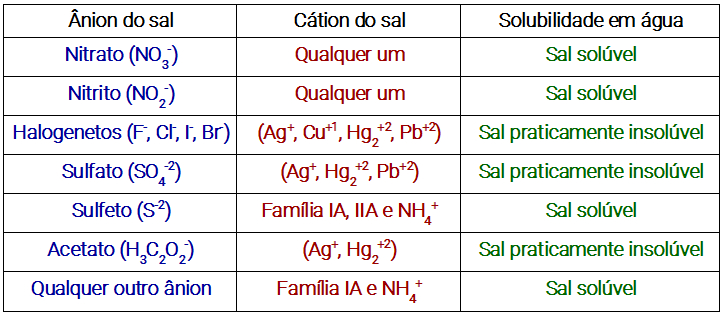
Quadro de solubilidade para sais
Veja alguns exemplos de aplicações das regras do quadro acima:
-
PbI2 (Iodeto de chumbo II): temos halogeneto com Pb, logo ele é praticamente insolúvel.
-
Ag2SO4 (Sulfato de prata): temos um sulfato com Ag, logo ele é praticamente insolúvel.
-
Na2Cr2O7 (Dicromato de sódio): Temos um ânion qualquer com o Na que é da família I A, logo ele é solúvel.
-
(NH4)3PO4 (Fosfato de amônio): Temos um ânion qualquer com o NH4, logo ele é solúvel.
-
Cu2S (Sulfeto de cobre I): Temos um ânion sulfeto sem cátion da I A, II A e NH4, logo ele é praticamente insolúvel.
Por Me. Diogo Lopes Dias
Videoaula relacionada: