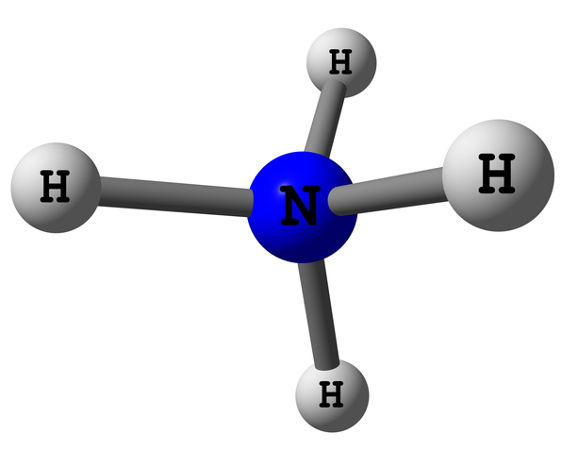
As aminas são bases orgânicas, que são obtidas a partir da substituição de um, dois ou três átomos de hidrogênio da amônia (NH3) por cadeias carbônicas. Portanto, o grupo funcional das aminas pode ser um dos três abaixo:
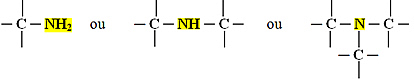
Grupo funcional das aminas
De acordo com a quantidade de hidrogênios substituídos, as aminas podem ser classificadas em:
-
Aminas primárias: 1 hidrogênio substituído;
-
Aminas secundárias: 2 hidrogênios substituídos;
-
Aminas terciárias: 3 hidrogênios substituídos.
A nomenclatura oficial das aminas primárias segue a seguinte regra estabelecida pela IUPAC:
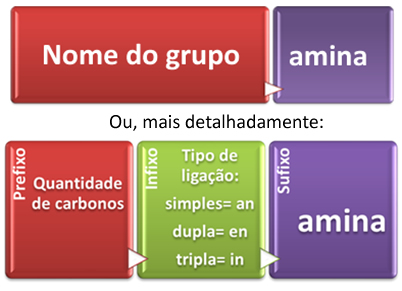
Principais componentes da nomenclatura das aminas primárias
Lembrando que se houver insaturações ou ramificações, é necessário numerar a cadeia partindo da extremidade mais próxima do grupo NH2 e mostrar em qual carbono ocorre:
Exemplos:
H3C — NH2: metanamina
H3C — CH2 —NH2: etanamina
H3C — CH2 — CH2 — CH2 —NH2: butan-1-amina
NH2
|
H3C — CH — CH2 — CH2 — CH2 —CH3: hexan-2-amina
NH2
|
H3C — CH2 — CH — C = CH — CH3: hex-3-en-3-amina
CH3 NH2
| |
H3C — CH — CH — CH2 —CH3: 2-metil-pentan-3-amina
CH3 NH2
| |
H3C — CH — CH2 — CH —CH3: 4-metil-pentan-2-amina
Principais propriedades das aminas:
As aminas possuem caráter básico porque elas derivam da amônia e seu átomo de nitrogênio possui um par de elétrons não compartilhados, sendo possível, portanto, oferecer esse par de elétrons (segundo a teoria eletrônica de Gilbert Newton Lewis, uma base é toda espécie química capaz de oferecer um par de elétrons). Além disso, o par de elétrons possibilita que as aminas também possam receber um próton H+ (segundo a teoria protônica de Brønsted-Lowry, base é toda espécie química capaz de receber um próton H+).
As aminas podem ser encontradas nas condições ambientes dos três estados de agregação:
-
Gases: Aminas com 1 a 3 substituintes metil e a etilamina;
-
Líquidas: Da propilamina à dodecilamina;
-
Sólidas: Aminas com mais de 12 átomos de carbono (acima da dodecilamina) são sólidas.
A metilamina e a etilamina têm o cheiro parecido com o da amônia, as demais aminas possuem cheiro de peixe, que pode ser eliminado com caldo de limão. Inclusive, uma das aminas responsáveis pelo cheiro do próprio peixe é a trimetilamina.

A trimetilamina é responsável pelo cheiro de peixe podre
As aminas aromáticas são tóxicas e letais.
Aminas no cotidiano:
No cotidiano, esse grupo funcional é encontrado nas moléculas de muitas substâncias estimulantes e em drogas, tais como a cafeína, a nicotina, anfetaminas (um de seus derivados é o ecstasy), a cocaína e o crack.
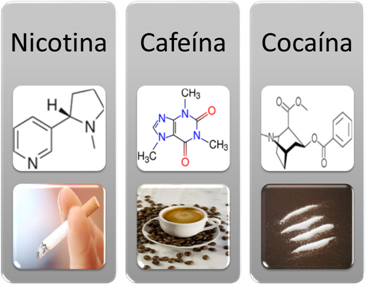
Exemplos de aminas estimulantes: nicotina, cafeína e cocaína
As vitaminas fundamentais para a manutenção da vida são também aminas, daí o seu nome: “vital + amina”. Mas nem todas as vitaminas são aminas. Nos alimentos e no nosso organismo existem também os aminoácidos, que são compostos com o grupo amino e também com o grupo carboxila.
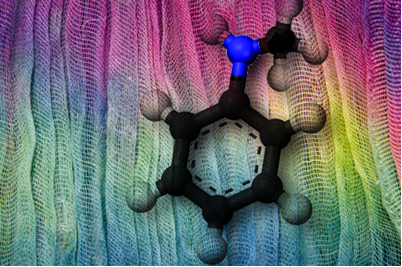
Também estão presentes em anestésicos, antibióticos, um exemplo é a penicilina, e em antidepressivos, como a fluoxetina.

Molécula de fluoxetina, caixa e cartela de pílulas de medicamento antidepressivo*
As aminas são usadas na síntese de compostos orgânicos, na produção de certos tipos de sabões e na vulcanização da borracha. As aminas aromáticas são muito usadas na fabricação de corantes (como a anilina, que é a benzenoamina) e de explosivos.
* Crédito editorial pela imagem: Autor: Lanfear's Bane/ Fonte: Wikipedia Commons
Por Jennifer Fogaça
Graduada em Química
Videoaula relacionada: