Reações orgânicas de redução são fenômenos químicos que ocorrem sempre que determinados compostos orgânicos oxigenados (formados por carbono, hidrogênio e oxigênio) e nitrogenados (formados por carbono, hidrogênio e nitrogênio) sofrem ataque de átomos de hidrogênio ([H]) provenientes da substância gás hidrogênio (H2) em meio a níquel metálico (Ni) ou da substância hidreto de lítio e alumínio (LiAlH4) aquoso (misturado à água).
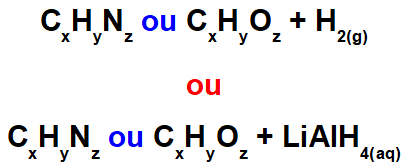
Representação geral dos reagentes de uma reação orgânica de redução
Quando o gás hidrogênio está na presença do níquel metálico, o metal atua de forma catalítica sobre as moléculas do gás H2. Essa ação catalítica é descrita como uma adsorção (prisão ou interação) das moléculas de H2 seguida do rompimento da ligação sigma entre os átomos de hidrogênio, os quais passam a ser denominados hidrogênios nascentes [H].
Veja também: Catalisador
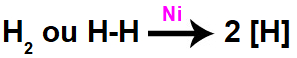
Equação química de formação de hidrogênios nascentes a partir da ação catalítica no H2
Quando o hidreto de lítio e alumínio (LiAlH4) está na presença de água, ocorre uma violenta reação química, formando hidróxido de lítio (LiOH), hidróxido de alumínio [Al(OH)3] e átomos de hidrogênio, os quais passam a ser denominados hidrogênios nascentes [H].
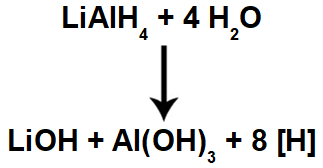
Equação química de formação de hidrogênios nascentes a partir do hidreto de lítio e alumínio em meio aquoso
Veja também: nomenclatura das bases
Os hidrogênios nascentes são responsáveis por atacar moléculas orgânicas nitrogenadas ou oxigenadas, formando novos produtos. A reação orgânica de redução ocorre em apenas alguns tipos de compostos, porque os átomos de hidrogênios nascentes atacam somente regiões que apresentam ligações insaturadas (ligações duplas ou triplas), pois sempre serão adicionados a essas estruturas.
1- Reação orgânica de redução em compostos oxigenados
1.1- Ácidos carboxílicos
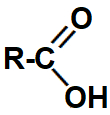
Representação da carboxila, grupo que identifica um ácido carboxílico
Quando os hidrogênios nascentes (sejam eles provenientes de gás H2 ou de LiAlH4(aq)) são colocados no mesmo recipiente que um ácido carboxílico, atacam a ligação pi presente na carboxila, rompendo essa ligação e formando duas valências livres (uma no carbono e outra no oxigênio).
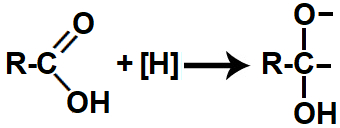
Representação das valências livres formadas na redução do ácido carboxílico
Em seguida, cada uma das valências livres criadas é preenchida por átomos de hidrogênios nascentes ([H]), originando um diálcool gemino (álcool que possui dois grupos de hidroxila [OH] no mesmo carbono).
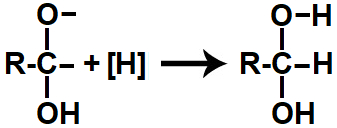
Representação do produto da redução orgânica de um ácido carboxílico
A presença de dois grupos de hidroxila, por serem muito eletronegativos, gera uma grande instabilidade na cadeia carbônica. Por isso, ocorre uma monodesidratação (perda de uma molécula de água) do diálcool formado, dando origem a uma água formada por uma hidroxila completa e por apenas um hidrogênio da outra hidroxila.
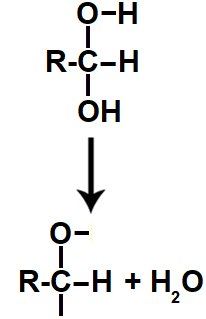
Equação da monodesidratação do diálcool
A partir desse ponto da reação de redução do ácido carboxílico, ocorrem duas situações:
-
Primeira: átomos de hidrogênios nascentes ocupam as valências livres formadas na monodesidratação, resultando em um álcool primário (aquele em que o carbono ligado ao grupo OH possui também uma ligação com outro carbono).
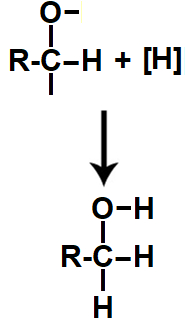
Equação da formação do álcool na redução do ácido carboxílico
-
Segunda: entre o carbono e o oxigênio, que possuem valências livres, é formada uma ligação pi, transformando a ligação simples em dupla. Além disso, um hidrogênio nascente liga-se ao carbono. Como resultado, forma-se um aldeído.
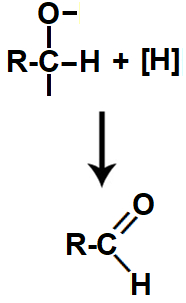
Equação da formação do aldeído na redução do ácido carboxílico
Temos então que, ao final de uma reação de redução de um ácido carboxílico, sempre teremos a formação de aldeído e álcool primário.
1.2- Aldeídos
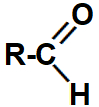
Representação da carbonila que identifica um aldeído
Quando os hidrogênios nascentes são colocados no mesmo recipiente que um aldeído, atacam a ligação pi presente na carbonila, rompendo essa ligação e formando duas valências livres (uma no carbono e outra no oxigênio).
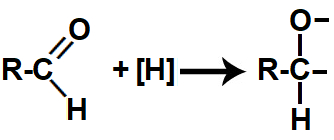
Representação das valências livres formadas durante a redução do aldeído
Em seguida, cada uma das valências livres criadas é preenchida por átomos de hidrogênios nascentes ([H]), dando origem a um álcool.
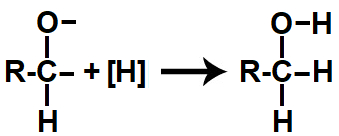
Representação do produto formado na redução orgânica de um aldeído
1.3- Cetonas
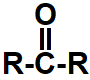
Representação da carbonila que identifica uma cetona
Quando os hidrogênios nascentes são colocados no mesmo recipiente que uma cetona, atacam a ligação pi presente na carbonila, rompendo essa ligação e formando duas valências livres (uma no carbono e outra no oxigênio).
.jpg)
Representação das valências livres formadas durante a redução da cetona
Em seguida, cada uma das valências livres criadas é ocupada por um átomo de hidrogênio nascente ([H]), dando origem a um álcool secundário (aquele em que o carbono que possui o grupo OH liga-se também a outros dois carbonos).
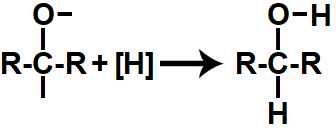
Representação do produto formado na redução orgânica de uma cetona
2- Reação orgânica de redução em compostos nitrogenados
2.1- Amidas
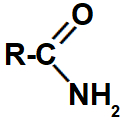
Representação do grupo que identifica uma amida
Quando os hidrogênios nascentes (provenientes do gás H2 ou do LiAlH4(aq)) são colocados no mesmo recipiente que uma amida, atacam a ligação dupla entre o carbono e o oxigênio, rompendo-a e formando quatro valências livres (duas no carbono e duas no oxigênio).
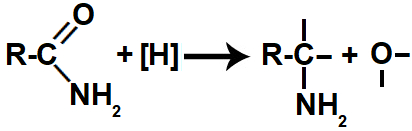
Representação das valências livres formadas durante a redução de uma amida
Em seguida, cada uma das valências livres criadas é ocupada por um átomo de hidrogênio nascente ([H]), dando origem a uma amina e a uma molécula de água.
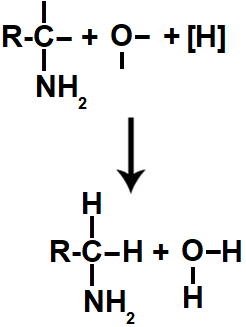
Representação do produto formado na redução orgânica de uma amida
2.2- Nitrocompostos
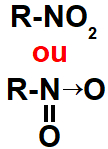
Representação do grupo que identifica um nitrocomposto
Quando os hidrogênios nascentes são colocados no mesmo recipiente que um nitrocomposto, atacam a ligação dupla ente o nitrogênio e o oxigênio e a ligação dativa entre esse nitrogênio e o outro oxigênio, rompendo-as e formando quatro valências livres (duas no oxigênio e outras duas no nitrogênio):
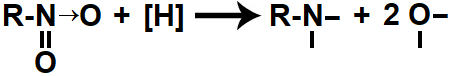
Representação das valências livres formadas durante a redução de um nitrocomposto
Em seguida, cada uma das valências livres criadas é ocupada por um átomo de hidrogênio nascente ([H]), dando origem a uma amina e a duas moléculas de água.
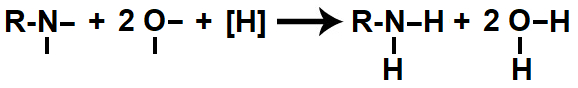
Representação do produto formado na redução orgânica de um nitrocomposto
2.3- Nitrilos
![]()
Representação do cianeto, grupo que identifica um nitrilo
Quando os hidrogênios nascentes são colocados no mesmo recipiente que um nitrilo, atacam as duas ligações pi existentes entre o carbono e o nitrogênio, rompendo-as e formando quatro valências livres (duas no carbono e outras duas no nitrogênio):
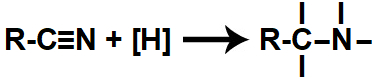
Representação das valências livres formadas durante a redução de um nitrilo
Em seguida, cada uma das valências livres criadas é ocupada por um átomo de hidrogênio nascente ([H]), dando origem a uma amina.
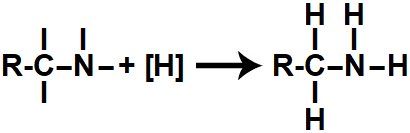
Representação do produto formado na redução orgânica de um nitrilo
2.4- Isonitrilos
![]()
Representação do cianeto, grupo que identifica um isonitrilo
Quando os hidrogênios nascentes são colocados no mesmo recipiente que um isonitrilo, atacam a ligação pi e a ligação dativa existentes entre o carbono e o nitrogênio, rompendo-as e formando quatro valências livres (três no carbono e uma no nitrogênio).
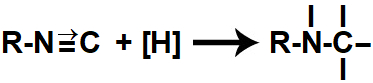
Representação das valências livres formadas durante a redução de um isonitrilo
Em seguida, cada uma das valências livres criadas é ocupada por um átomo de hidrogênio nascente ([H]), dando origem a uma amina.
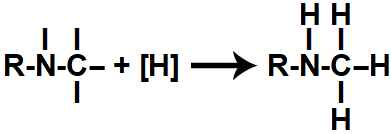
Representação do produto formado na redução orgânica de um isonitrilo
Veja também: reações orgânicas de oxidação